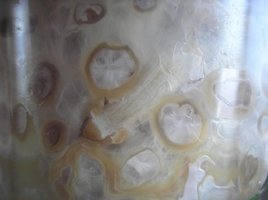
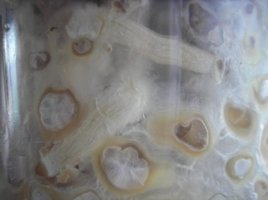
Olá.
Este é o segundo cultivo que eu faço na vida, mas o primeiro que eu faço o diário aqui no CM. Na época do meu primeiro cultivo, a quase 3 anos atrás, eu era menos participativo, embora eu deva o parcial sucesso da primeira tentativa à tudo que eu aprendi aqui.
Bem. Começando.
O cultivo na verdade já está em andamento. Pode-se dizer que eu "trapaceei" por apenas ter criado o tópico depois de ver que as coisas estavam dando certo. Na realidade é que como eu já havia cultivado antes, eu já sabia bem o que esperar. Então achei que seria melhor abrir o diário ao ver os primeiros sinais de micélio do que criar um tópico que poderia logo ser abandonado caso o cultivo fracassasse no início.
Estou cultivando as strains Ecuador e Mazatapec, mas tenho ainda um carimbo fechadinho de Thai Na Muang, que estou decidindo se já meto de uma vez ou se deixo pra próxima.
Acho que vou metê-lhe.
Hahahaha
Os substratos são:
3 copos com milho de pipoca, mais 1, fruto de uma ideia que eu tive e resolvi testar (antes de ver que já havia no forum).
Este é uma mistura de:
1/2 copo de vermiculita
Quase 1/2 de milho quebrado (daqueles de dar pras galinhas)
Mais um punhado de quirela de arroz
Mais uma pitada de niger e semente de linhaça.
Mais água fervida até a mistura ficar úmida, mas sem pingar água quando apertada na mão.
Os quatro copos:

Nada de café nem estabilizantes de PH.
De todos os 4 copos serão feitos casings. Eu não tenho certeza se este substrato de vermiculita e milho quebrado frutificaria sem o casing, mas pelo sim pelo não, vou fazer casing, pq nunca me dei muito bem só com o bolo.
No próximo post colocarei os passos para este não ficar muito longo. Tenho mania de me empolgar falando.
Este é o segundo cultivo que eu faço na vida, mas o primeiro que eu faço o diário aqui no CM. Na época do meu primeiro cultivo, a quase 3 anos atrás, eu era menos participativo, embora eu deva o parcial sucesso da primeira tentativa à tudo que eu aprendi aqui.
Bem. Começando.
O cultivo na verdade já está em andamento. Pode-se dizer que eu "trapaceei" por apenas ter criado o tópico depois de ver que as coisas estavam dando certo. Na realidade é que como eu já havia cultivado antes, eu já sabia bem o que esperar. Então achei que seria melhor abrir o diário ao ver os primeiros sinais de micélio do que criar um tópico que poderia logo ser abandonado caso o cultivo fracassasse no início.
Estou cultivando as strains Ecuador e Mazatapec, mas tenho ainda um carimbo fechadinho de Thai Na Muang, que estou decidindo se já meto de uma vez ou se deixo pra próxima.
Acho que vou metê-lhe.
Hahahaha
Os substratos são:
3 copos com milho de pipoca, mais 1, fruto de uma ideia que eu tive e resolvi testar (antes de ver que já havia no forum).
Este é uma mistura de:
1/2 copo de vermiculita
Quase 1/2 de milho quebrado (daqueles de dar pras galinhas)
Mais um punhado de quirela de arroz
Mais uma pitada de niger e semente de linhaça.
Mais água fervida até a mistura ficar úmida, mas sem pingar água quando apertada na mão.
Os quatro copos:

Nada de café nem estabilizantes de PH.
De todos os 4 copos serão feitos casings. Eu não tenho certeza se este substrato de vermiculita e milho quebrado frutificaria sem o casing, mas pelo sim pelo não, vou fazer casing, pq nunca me dei muito bem só com o bolo.
No próximo post colocarei os passos para este não ficar muito longo. Tenho mania de me empolgar falando.