Saudações a todos os irmãos fungi.
Moro no Litoral do Ceará, e comecei a pouco tempo a me interessar pelos cubensis, adquiri através da internet um casing de B+, onde realizei a frutificação e obtive uma colheita bacana, modesta, mas que me renderam boas experiências e interações com o senhor cogumelo.
Inicialmente Comprei o casing apenas para frutificar, colher e desfrutar, porém eu ouvi o chamado da minha voz interior e fui impulsionado através de uma catálise fungica, estudando e desbravando esse reino tão maravilhoso chamado reino fungi.
CASING COMPRADO PRONTO PARA FRUTIFICAÇÃO E POSTERIORMENTE UTILIZADO PARA A PRODUÇÃO DE CARIMBO



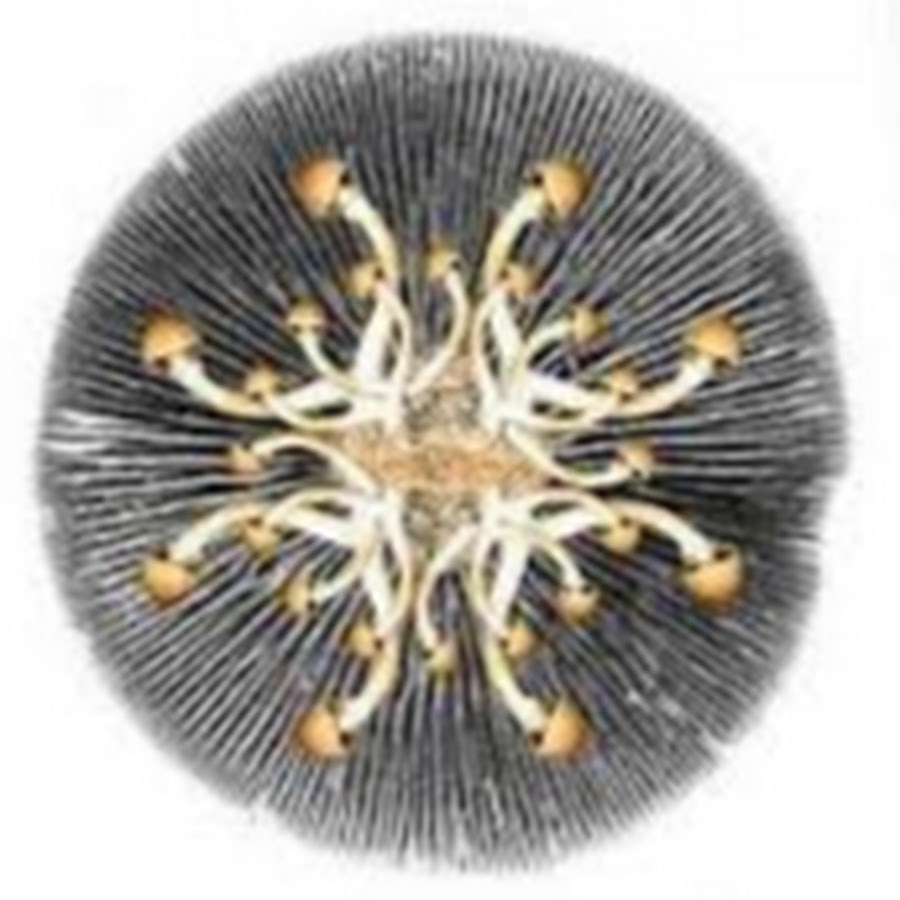
Dado o fato, realizei a confecção de esporos de carimbos com papel alúminio desinfectado com álcool 70 %
CARIMBO DE ESPOROS


Após a confecção do carimbo foi realizada a confecção do Substrato, onde foi escolhido o Substrato PFTek, utilizando sua receita clássica e tendo os cuidados e parâmetros ideais para a correta umidade e consistência do substrato, também utilizei selamento com vermiculita seca e selei a boca dos copos com papel alumínio e fita isolante. O Objetivo é posteriormente usar os 2 copos menores(boca mais larga que o fundo) como bolo e os 2 maiores para a produção de uma casing. (Fiz um teste inicial com milho de pipoca também, porém não fotografei e creio que vá contaminar, tendo em vista que esqueci do selamento com papel alumínio e entrou água pela tampa, mas mesmo assim realizei a inoculação e estou aguardando resultado, vai servir como grupo controle, pelo menos)
SUBSTRATO PFTEK


Com os copos com o substrato já finalizados utilizei o método de esterelização na Panela de pressão, onde o procedimento utilizado foi: 2 Panos no fundo da panela para evitar o contato dos potes o fundo da panela, água até mais ou menos 1/3 dos potes, após isso coloquei no fogo, esperei pegar pressão, diminui a fogo médio e deixei por 1 hora. Após esse tempo deixei esfriando por mais ou menos 4 a 5 horas.
ESTERELIZAÇÃO

Seguindo, nós fomos para a parte da inoculação, foi feita a desinfecção prévia com álcool 70 etílico e em gel da bancada de estudo, dos materiais utilizados tais como(Lamparina, frasco do álcool 70% etílico, frasco do álcool em gel, Avental cirúrgico e luvas estéreis, copos com substrato). Através do Carimbo(Foto 4) Foi feito 2 Seringas de esporos uma de 10 e outra de 20, utilizando o seguinte procedimento: Um pote pequeno desinfetado com álcool 70% e preenchido com água para injetáveis(água destilada). Foi utilizado um bisturi 15c para raspar os esporos do papel alumínio para o pote com água destilada, após isso foi feito a remoção da seringa utilizando técnica asséptica, com isso puncionamos e injetamos o líquido com os esporos para mistura e por fim puncionamos e ficamos com 2 seringas cheias, seringas essas que não estavam escuras, acredito eu que utilizei muita água destilada, porém são seres microscópicos e acredito na potencia da seringa mesmo não estando mais escura(tomara que esteja certo, estou indo pela lógica dos estudos e não pela experiência real, me corrijam se eu estiver errado)
Utilizei o seguinte procedimento: Tomei banho com asseptol, vesti uma roupa limpa e cheirosa, coloquei o avental cirúrgico através da técnica asséptica, calcei a luva cirúrgica 7, utilizando a técnica correta para não contaminar(peguei esses materiais e algumas técnicas do meu consultório e profissão, de certa forma me ajudou a ser rigoroso e entender a possibilidade de contaminações). Já equipado Com o local sem correntes de ar(Não utilizei glovebox), acendi a lamparina e comecei a trabalhar na inoculação, tentando ser preciso e técnico, a fim de não abrir brechas para contaminação, o procedimento utilizado foi: Flambajem da ponta da agulha por 2 segundos, tirar e esperar por 2 segundos, retirar com cuidado a segunda camada de papel alumínio, injetar cerca de 1 ml em 4 pontos equidistantes, cobrir com fita micro porosa(cortada previamente) os 4 furos e tampar novamente com a segunda camada de papel alumínio. Realizei o mesmo procedimento para os 4 copos.
INOCULAÇÃO








Após esse procedimento foram colocados os 4 copos inoculados na incubadora (01/10/2020) 15:30
A Incubadora consiste em um cooler(Onde se encontram os bolos PFTek) e uma caixa organizadora(onde se encontra o grupo controle, onde foi inoculado os milhos com infiltração de água)
A temperatura média do ambiente está em 29 graus, as incubadoras estão em local calmo, ventilado e seguro.
8 Dias se passaram, estou esperando chegar no dia 20 após a inoculação e verificar se há presença de micélio ou de contaminação, pacientemente esperarei e quando chegar a hora eu retorno e dou seguimento ao nosso estudo.
Gostaria de agradecer a todos desde já e me desculpar se não fui claro em algum momento ou se fiz algo errado em relação a postagem, peço gentilmente que se algo estiver errado remova ou mova o meu post, o intuito aqui é mostrar o estudo e tentar de certa forma passar um pouco do conhecimento que eu adquiri aqui com os irmãos do fórum.
Referencial teórico:
 www.youtube.com
EDITADO - ECUADOR - sem menção a lojas, por favor
www.youtube.com
EDITADO - ECUADOR - sem menção a lojas, por favor

 www.youtube.com
www.youtube.com
IN SCIENCE WE TRUST
Moro no Litoral do Ceará, e comecei a pouco tempo a me interessar pelos cubensis, adquiri através da internet um casing de B+, onde realizei a frutificação e obtive uma colheita bacana, modesta, mas que me renderam boas experiências e interações com o senhor cogumelo.
Inicialmente Comprei o casing apenas para frutificar, colher e desfrutar, porém eu ouvi o chamado da minha voz interior e fui impulsionado através de uma catálise fungica, estudando e desbravando esse reino tão maravilhoso chamado reino fungi.
CASING COMPRADO PRONTO PARA FRUTIFICAÇÃO E POSTERIORMENTE UTILIZADO PARA A PRODUÇÃO DE CARIMBO



Dado o fato, realizei a confecção de esporos de carimbos com papel alúminio desinfectado com álcool 70 %
CARIMBO DE ESPOROS


Após a confecção do carimbo foi realizada a confecção do Substrato, onde foi escolhido o Substrato PFTek, utilizando sua receita clássica e tendo os cuidados e parâmetros ideais para a correta umidade e consistência do substrato, também utilizei selamento com vermiculita seca e selei a boca dos copos com papel alumínio e fita isolante. O Objetivo é posteriormente usar os 2 copos menores(boca mais larga que o fundo) como bolo e os 2 maiores para a produção de uma casing. (Fiz um teste inicial com milho de pipoca também, porém não fotografei e creio que vá contaminar, tendo em vista que esqueci do selamento com papel alumínio e entrou água pela tampa, mas mesmo assim realizei a inoculação e estou aguardando resultado, vai servir como grupo controle, pelo menos)
SUBSTRATO PFTEK


Com os copos com o substrato já finalizados utilizei o método de esterelização na Panela de pressão, onde o procedimento utilizado foi: 2 Panos no fundo da panela para evitar o contato dos potes o fundo da panela, água até mais ou menos 1/3 dos potes, após isso coloquei no fogo, esperei pegar pressão, diminui a fogo médio e deixei por 1 hora. Após esse tempo deixei esfriando por mais ou menos 4 a 5 horas.
ESTERELIZAÇÃO

Seguindo, nós fomos para a parte da inoculação, foi feita a desinfecção prévia com álcool 70 etílico e em gel da bancada de estudo, dos materiais utilizados tais como(Lamparina, frasco do álcool 70% etílico, frasco do álcool em gel, Avental cirúrgico e luvas estéreis, copos com substrato). Através do Carimbo(Foto 4) Foi feito 2 Seringas de esporos uma de 10 e outra de 20, utilizando o seguinte procedimento: Um pote pequeno desinfetado com álcool 70% e preenchido com água para injetáveis(água destilada). Foi utilizado um bisturi 15c para raspar os esporos do papel alumínio para o pote com água destilada, após isso foi feito a remoção da seringa utilizando técnica asséptica, com isso puncionamos e injetamos o líquido com os esporos para mistura e por fim puncionamos e ficamos com 2 seringas cheias, seringas essas que não estavam escuras, acredito eu que utilizei muita água destilada, porém são seres microscópicos e acredito na potencia da seringa mesmo não estando mais escura(tomara que esteja certo, estou indo pela lógica dos estudos e não pela experiência real, me corrijam se eu estiver errado)
Utilizei o seguinte procedimento: Tomei banho com asseptol, vesti uma roupa limpa e cheirosa, coloquei o avental cirúrgico através da técnica asséptica, calcei a luva cirúrgica 7, utilizando a técnica correta para não contaminar(peguei esses materiais e algumas técnicas do meu consultório e profissão, de certa forma me ajudou a ser rigoroso e entender a possibilidade de contaminações). Já equipado Com o local sem correntes de ar(Não utilizei glovebox), acendi a lamparina e comecei a trabalhar na inoculação, tentando ser preciso e técnico, a fim de não abrir brechas para contaminação, o procedimento utilizado foi: Flambajem da ponta da agulha por 2 segundos, tirar e esperar por 2 segundos, retirar com cuidado a segunda camada de papel alumínio, injetar cerca de 1 ml em 4 pontos equidistantes, cobrir com fita micro porosa(cortada previamente) os 4 furos e tampar novamente com a segunda camada de papel alumínio. Realizei o mesmo procedimento para os 4 copos.
INOCULAÇÃO








Após esse procedimento foram colocados os 4 copos inoculados na incubadora (01/10/2020) 15:30
A Incubadora consiste em um cooler(Onde se encontram os bolos PFTek) e uma caixa organizadora(onde se encontra o grupo controle, onde foi inoculado os milhos com infiltração de água)
A temperatura média do ambiente está em 29 graus, as incubadoras estão em local calmo, ventilado e seguro.
8 Dias se passaram, estou esperando chegar no dia 20 após a inoculação e verificar se há presença de micélio ou de contaminação, pacientemente esperarei e quando chegar a hora eu retorno e dou seguimento ao nosso estudo.
Gostaria de agradecer a todos desde já e me desculpar se não fui claro em algum momento ou se fiz algo errado em relação a postagem, peço gentilmente que se algo estiver errado remova ou mova o meu post, o intuito aqui é mostrar o estudo e tentar de certa forma passar um pouco do conhecimento que eu adquiri aqui com os irmãos do fórum.
Referencial teórico:
Esporos no ar
Fumaça Mágica
No Canal Fumaça Mágica iremos falar sobre temas relacionados a Cannabis, Cogumelos Mágicos, Gnomos, As Pirâmides do Egito e de todas as outras Pirâmides da T...
IN SCIENCE WE TRUST
Anexos
-
 IMG_20201002_230305.jpg2.6 MB · Visualizações: 11
IMG_20201002_230305.jpg2.6 MB · Visualizações: 11 -
 IMG_20201002_225256.jpg740.2 KB · Visualizações: 9
IMG_20201002_225256.jpg740.2 KB · Visualizações: 9 -
 IMG_20201002_225224.jpg996 KB · Visualizações: 8
IMG_20201002_225224.jpg996 KB · Visualizações: 8 -
 IMG_20201002_101110 (1).jpg941.7 KB · Visualizações: 6
IMG_20201002_101110 (1).jpg941.7 KB · Visualizações: 6 -
 IMG_20201002_100828 (1).jpg2.9 MB · Visualizações: 6
IMG_20201002_100828 (1).jpg2.9 MB · Visualizações: 6 -
 IMG_20201002_224923 (1).jpg925 KB · Visualizações: 6
IMG_20201002_224923 (1).jpg925 KB · Visualizações: 6 -
 IMG_20201002_224902 (1).jpg770 KB · Visualizações: 5
IMG_20201002_224902 (1).jpg770 KB · Visualizações: 5 -
 IMG_20201002_101110.jpg941.7 KB · Visualizações: 4
IMG_20201002_101110.jpg941.7 KB · Visualizações: 4 -
 IMG_20201002_100828.jpg2.9 MB · Visualizações: 3
IMG_20201002_100828.jpg2.9 MB · Visualizações: 3 -
 IMG_20201002_224923.jpg925 KB · Visualizações: 2
IMG_20201002_224923.jpg925 KB · Visualizações: 2
Última edição por um moderador:


































































