PARTE FINAL
É UM PEDAÇO DE BOLO... DENTRO DE UMA SERINGA
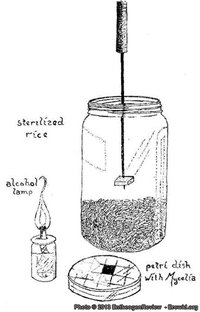
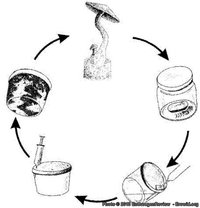
Primeiro, pegue um copo com um bolo de substrato – de preferência um que acabou de colonizar. Coloque-o em um ambiente livre de correntes de ar em uma superfície limpa (se você trabalha na cozinha, feche as janelas e portas). Coloque uma pequena panela de água para ferver. Encha uma seringa vazia com água fervente. Coloque uma faca afiada com a lâmina dentro da panela de água fervente e desligue o fogo. Coloque o copo de substrato de cabeça para baixo sobre um pedaço de papel sobre a superfície de trabalho. Após cerca de um minuto, esvazie a seringa na panela. Então tire o êmbolo da seringa, coloque-o na água quente, remova o vidro de cima do substrato e espete a seringa vazia, agulha para baixo, no topo do bolo. Tire a faca da água quente, corte fora um pequeno pedaço da aresta do bolo e coloque dentro do corpo da seringa. Remova a seringa do bolo e reinsira o êmbolo. Aponte a seringa para cima e esvazie o ar da seringa. Coloque o copo novamente sobre o bolo e guarde novamente esse “bolo mãe” na geladeira. Se tudo tiver dado certo agora você tem um pedaço de bolo limpo dentro de uma seringa limpa.
Agora sugue 1ml de agua fria e limpa (da torneira ou engarrafada) para dentro da seringa, 0,2ml de peróxido de hidrogênio 3% (de preferência de um frasco novo e lacrado) e um pouco do ar mais limpo que você tiver disponível (você pode puxar ar logo acima da chama de uma lamparina de álcool para garantir que esteja limpo). Chacoalhe a seringa vigorosamente, ejete o ar (com a seringa apontando para cima) e encha a seringa com água limpa e fria. Permita que o peróxido aja por cinco minutos e então inocule um novo copo de Substrato PF.
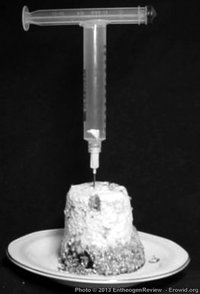
Um pedaço de bolo de substrato dentro de uma seringa com o êmbolo equilibrado em cima, pronto para ser transformar em uma pasta de micélio.
ALTERNATIVAS?
Existem dois esboços de alternativas à ideia de manter um “bolo mãe” na geladeira. Um é fazer a técnica de micélio-água peroxidado do CountZero e guardá-la. A outra é não usar um bolo mãe mas copiar cada bolo no momento em que é colonizado (fazendo cópias de cópias, de cópias). Embora ambas alternativas possam parecer atalhos, elas são na realidade becos sem saída.
A razão para não armazenar micélio-água foi menciona anteriormente por Wayne e CountZero. Se houver bastante peroxido na água ele irá dominar as enzimas peroxidase e matar o micélio com o passar do tempo. Por outro lado, se as enzimas peroxidase conseguirem destruir o peróxido, o micélio-água fica passível de contaminação. Mas mesmo que nenhuma contaminação ocorra, solução de micélio-água de Psylocibe cubensis não dura muito tempo se comparado a
esporo-água. É muito melhor armazenar spawn sólido.
Fazer cópias de cópias também não é uma boa ideia, porque nenhum organismo vivo foi desenvolvido para uma quantidade ilimitada de divisões celulares. O micélio não é uma exceção. Eventualmente ele se tornará senescente (processo metabólico de envelhecimento celular) e perderá a habilidade de produzir cogumelos. A ideia de manter um bolo mãe para clonagem tem o objetivo de adiar este momento o máximo possível mantendo uma linhagem de células jovens.
Então eventualmente cada cultivador tem que germinar uma nova
strain de esporos. Já que esporos são unicelulares não é possível fazer uma solução esporo-água peroxidada. Felizmente, até em um ambiente não-estéril é possível germinar esporos em um tubo de ensaio sem a adição de peróxido. Você só precisa de um isqueiro para isto. (Obtenha o segundo volume do manual de Wayne se quiser ler sobre este processo).
Com estas técnicas novas é finalmente possível cultivar cogumelos a partir de esporos ou micélio sem a necessidade de um espaço de trabalho estéril e sem a necessidade de comprar uma
seringa de esporos. Contudo, estes métodos provavelmente não são reais substitutos para a seringa de esporos. Isto porque a germinação de esporos de cogumelos em um meio que não seja o substrato de
frutificação (e a produção de uma pasta de micélio que possa ser injetada neste último) facilmente reque de uma a três semanas extras se comparado com uma simples inoculação com uma seringa de esporos. Mais importante é que as novas técnicas para fazer pastas de micélio ainda não são “à prova de idiotas” (=à prova de contaminações) como o método de seringa de esporos, contanto que a seringa de esporos seja obtida de um vendedor que garanta sua viabilidade. Além disso, considerando que vários vendedores agora fornecem seringas de esporos por U$10,00 ou menos, fica a questão se as técnicas requeridas para coletar esporos, germiná-lo sem tubos de ensaios e fazer uma solução de água-micélio peroxidada realmente valem a pena, já que estes passos levarão mais de uma hora para serem completados e para muitas pessoas uma hora de seu tempo vale mais de U$10,00. Especialmente se a seringa vier de um vendedor que garanta sua viabilidade, será difícil encontrar um método com melhor custo-benefício. Enquanto eu escrevia este artigo, Psylocibe Fanaticus oferecia a melhor garantia de viabilidade, afirmando: “Garantimos que as seringas são limpas, viáveis e autênticas, ou seu dinheiro será devolvido ou a seringa substituída até que sua satisfação seja atingida”.
O FUTURO
A combinação de seringa de esporos, substrato de arroz integral em pó/
vermiculita, e a barreira de vermiculita seca contra contaminantes, combinados em um método para o “cultivo de mochila” pode muito bem ser a simplificação máxima para Psylocibe cubensis. O método do copo de dose grande se liga à PF TEK com os desenvolvimentos mais recentes para a produção em massa de outros cogumelos comestíveis. Na terceira edição da bíblia do cultivo de cogumelos “Growing Gourmet and Medicinal Mushrooms” (Ten Speed Press, 2000), o autor Paul Stamets explica:
O atalho final para cultivar cogumelos é via inoculação de massa/líquido diretamente nos substratos de frutificação (p.133). Cultura de garrafa é um meio eficiente para cultivar uma variedade de cogumelos comestíveis e medicinais em substratos esterilizados. Atualmente, cultivadores asiáticos adaptaram o cultivo em garrafas, originalmente projetado para facilitar a colheita de cogumelos Enoki (Flammulina velutipes), para o cultivo de muitos outros cogumelos comestíveis e medicinais, incluindo Juba-de-leão (Hericium erinaceus), Buna-shimeji (Hypsizygus tessulatus), Reishi (Ganoderma lucidum), Coguemlo Orelha de Madeira (Auricularia polytricha), e algumas variedade de cogumelos Ostra. A vantagem do cultivo em garrafas é que o processo pode ser altamente compartimentado e facilmente incorporado a muitos sistemas de produção em alta velocidade de outras indústrias. Com a evolução natural das técnicas, cultivadores asiáticos substituíram as garrafas por sacos cilíndricos de formato similar. Muitos cultivadores na Tailândia, Taiwan e Japão preferem este método híbrido. Inoculação líquida de meio estéril, suplementado, permite métodos de inoculação semelhantes a sistemas de alta-produção como os de fábricas de refrigerante. Com reengenharia, tal maquinário de produção linear de alta velocidade poderia ser aprimorado para cultivo em sacos e garrafas. (pp. 191-193)
Métodos similares a PF TEK se tornaram populares em livros introdutórios sobre microbiologia e biotecnologia (ver "Carpogenesis and Basidiosporogenesis" de Suki C. Croan). Está agora estabelecido que Psylocibe cubensis é o principal candidato para a biossíntese fácil de psilocibina e psilocina. A versão da PF TEK com copo de dose grande é o método mais fácil para cultivadores profissionais e iniciantes e as variedades de P. cubensis “Matías Romero” e “Golden Teacher” são os cogumelos com melhor performance em pó de arroz integral e vermiculita (pelo menos no momento). Mas isso não significa que toda a inovação chegou ao fim da linha psilocibina – pelo menos duas novas direções estão sendo cogitadas. A primeira é a busca por outra, preferencialmente mais potente, espécie de cogumelo que possa ser frutificada em um meio de grãos. Na década de 80, Gartz reportou sucesso com P. bohemica, P.natalensis e Gymnopilus purpuratus. No fórum da internet
www.shroomery.org há algumas belas fotos de outro pesquisador alemão chamado Electrolurch, que frutificou uma nova
strain do majestoso P. zapotecorum que ele coletou no México. Todo mês “novas” espécies cultiváveis de Psilocybe são citadas neste e em outros fóruns similares, como
www.theforestfloor.org,
www.mycotopia.net, e alt.drugs.mushrooms.
A outra direção interessante é a formulação de um meio de crescimento que permita ao fungo psilocibino biossintetizar triptaminas que normalmente são criadas artificialmente em laboratório, como 4-hidroxi-DET, 4-hidroxi-DPT e seus fosforiloxis correspondentes. Outros componentes psicoativos interessantes que poderiam possivelmente ser biossintetizados desta forma são ergina, 4-hidroxi-aMT, baeocistina, norbaeocistina, ésteres não-fosforil de triptaminas alquila metiladas e triptaminas 5-substituinte alquila Para estes experimentos os psilocibinos formadores de esclerótias Conocybe cyanopus, Inocybe aeruginascens, Psilocybe mexicana, P. semilanceata e P. tampanensis assim como os não formadores de esclerótia como P. azurescens, Panaeolus cyanescens, P. tropicalis e Pluteus salicinus podem ser muito úteis. Contudo nenhuma dessas espécies possui no momento um método de cultivo in vitro não estéril, simples, bem estabelecido e de bom desempenho. “Biossíntese de grife” via cogumelos é um território em grande parte inexplorado.
Em resumo ainda há muito a ser descoberto pelo(a) xamã de porão que acabou de começar seu hobby. Muito do equipamento do século XX já não é mais necessário, então não conhecer técnicas laboratoriais não é mais uma desculpa. O único ingrediente necessário para avançar é uma mente curiosa, já que o momento de cultivo fácil e independência dos “traficantes de rua” definitivamente chegou.
Referências
Badham, E.R. 1980. "The Effect of Light upon Basidiocarp Initiation in Psilocybe cubensis," Mycologia 72: 136-142.
Badham, E.R. 1982. "Tropisms in the mushroom Psilocybe cubensis," Mycologia 74: 275-279.
Badham, E.R. 1983. Cultural Studies on the Mushroom Psilocybe cubensis, Ph.D. Dissertation. University Microfilms, Ann Arbor, Michigan.
Gartz, J. 1993. Narrenschwamme-Psychotrope Pilze in Europa.
Gartz, J. 1996. Magic Mushrooms Around the World--A Scientific Journey Across Cultures and Time--The Case for Challenging Research and Value Systems. LIS Publications.
Ott, J. 1976. Hallucinogenic Plants of North America. Wingbow Press.
Ott, J. 1978. Teonanácatl: Hallucinogenic Mushrooms of North America. Madrona Publishers, Inc.
Kneebone, L.R. l960. "Methods for the production of certain hallucinogenic agarics," Developments in Industrial Microbiology 1: 109.
Ott, J. 1996. Pharmacotheon: Entheogenic Drugs, their Plant Sources and History, second edition, densified. Natural Products Co.
Pollock, S.H. 1977. Magic Mushroom Cultivation. Herbal Medicine Research Foundation.
Stafford, P. 1993. Psychedelics Encyclopedia. Ronin Publishing, 3rd Edition.
Stijve, T. 1992. "Psilocin, Psilocybin, Serotonin, and Urea in Panaeolus cyanescens from Various Origin," Persoonia 15(1): 117-121.
Revisão Histórica
v1.1 - Feb 21, 2013 - Published on Erowid. Fixed minor typos, dead links replaced with current ones, missing references added.
v1.0 - Winter 2001 - Published in The Entheogen Review.