Optei pela técnica dos bolos PF TEK para começar minhas experiências como micólogo. Para fazer os substratos optei por farinha de arroz e vermiculita.
Antes de começar meu 1º cultivo li fóruns do CM, fiz perguntas a micólogos mais experientes através da comunidade, vi o vídeo "Cultivo Fácil" algumas vezes (não aguento mais aquela musiquinha eletrônica alá anos 90 ), li também o guia ilustrado e botei a mão na massa.
), li também o guia ilustrado e botei a mão na massa.
2. guia ilustrado:
https://teonanacatl.org/threads/cultivo-básico-e-simples-ilustrado.8227/

2. Inseri um CD na manga da luva; passei cola de sapateiro na borda:

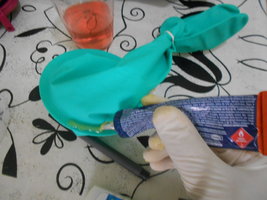
3. Passei a mesma cola na na borda dos orifícios da caixa; pousei a luva com o CD no orifício e aguardei 10 minutos pressionando para a cola secar:



4. Passei gel antifúngico e antibactericida nas bordas por cima da cola de sapateiro para reforçar o isolamento (opcional, creio eu); selei as bordas da tampa e da abertura da caixa para reforçar o isolamento.

5. Depois é só tirar o CD e pronto! o CD ajuda a manter a manga da luva aberta constantemente, favorecendo a aderência na região a ser colada. (foi uma ideia que tive e deu certo )
)
- água mineral: 160 ml
- vermiculita: 480 ml
Somando somente 800 ml (ao invés dos 900 que cabem nos copos) uma vez que os copos não devem ficar tão cheios. Deu certinho a quantidade, sobrando um dedo na borda superior dos copos para preenche-los com vermiculita seca e pura.
Um abraço acalorado e muito grato a todos da comunidade Cogumelos Mágicos!
Antes de começar meu 1º cultivo li fóruns do CM, fiz perguntas a micólogos mais experientes através da comunidade, vi o vídeo "Cultivo Fácil" algumas vezes (não aguento mais aquela musiquinha eletrônica alá anos 90
- Obs iniciais para outros cultivadores inexperientes (espero facilitar):
2. guia ilustrado:
https://teonanacatl.org/threads/cultivo-básico-e-simples-ilustrado.8227/
- Fiz meu 1º print a partir de chapéus de cogumelos maduros de um kit comprado; guardei eles dobrados em papel alumínio dentro de um saquinho ziplock.
- Confeccionei uma glovebox assim:

2. Inseri um CD na manga da luva; passei cola de sapateiro na borda:


3. Passei a mesma cola na na borda dos orifícios da caixa; pousei a luva com o CD no orifício e aguardei 10 minutos pressionando para a cola secar:



4. Passei gel antifúngico e antibactericida nas bordas por cima da cola de sapateiro para reforçar o isolamento (opcional, creio eu); selei as bordas da tampa e da abertura da caixa para reforçar o isolamento.

5. Depois é só tirar o CD e pronto! o CD ajuda a manter a manga da luva aberta constantemente, favorecendo a aderência na região a ser colada. (foi uma ideia que tive e deu certo
- Com a gluvebox pronta confeccionei minha primeira seringa.
- Preparação dos substratos (dosagens que utilizei para 2 copos de 300 ml e 2 copos de 150 ml - somando um total de 900 ml de substrato a ser preparado):
- água mineral: 160 ml
- vermiculita: 480 ml
Somando somente 800 ml (ao invés dos 900 que cabem nos copos) uma vez que os copos não devem ficar tão cheios. Deu certinho a quantidade, sobrando um dedo na borda superior dos copos para preenche-los com vermiculita seca e pura.
- Deixei na panela de pressão durante uma hora e botei na incubação (como moro no Rio e é verão creio que a temperatura natural do meu armário seja adequada)
Um abraço acalorado e muito grato a todos da comunidade Cogumelos Mágicos!
Última edição:








![DSCN0756[1].JPG DSCN0756[1].JPG](https://teonanacatl.org/data/attachments/68/68510-f60bac0cda4ba4421f01fa333360c966.jpg)
![DSCN0758[1].JPG DSCN0758[1].JPG](https://teonanacatl.org/data/attachments/68/68511-862c070366753d05c69bae9e8b5ca609.jpg)
![DSCN0759[1].JPG DSCN0759[1].JPG](https://teonanacatl.org/data/attachments/68/68512-bf97cbd92449d800ec19854f314c463a.jpg)
![DSCN0760[1].JPG DSCN0760[1].JPG](https://teonanacatl.org/data/attachments/68/68513-43e091fd8c205d05a1697d110525f11d.jpg)
![DSCN0762[1].JPG DSCN0762[1].JPG](https://teonanacatl.org/data/attachments/68/68514-6f32ba4c52bf386399483c809eb08510.jpg)
![DSCN0763[1].JPG DSCN0763[1].JPG](https://teonanacatl.org/data/attachments/68/68515-7fafd5056f253e3ad69ef30f8ed6d35e.jpg)
![DSCN0764[1].JPG DSCN0764[1].JPG](https://teonanacatl.org/data/attachments/68/68516-4fe9e63c355bf21a1d785d5d374f9786.jpg)
![DSCN0765[1].JPG DSCN0765[1].JPG](https://teonanacatl.org/data/attachments/68/68517-994729d9816ea04b42b24d9f1388e0d1.jpg)
![DSCN0766[1].JPG DSCN0766[1].JPG](https://teonanacatl.org/data/attachments/68/68518-73a6c6c9956a0e68242bfc766b86867d.jpg)
![DSCN0776[1].JPG DSCN0776[1].JPG](https://teonanacatl.org/data/attachments/68/68739-603a73a36721130d909b1fbc95870d82.jpg)
![DSCN0777[1].JPG DSCN0777[1].JPG](https://teonanacatl.org/data/attachments/68/68740-b013c0837ee019b3deb86b483d3750f6.jpg)



