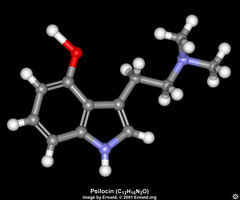
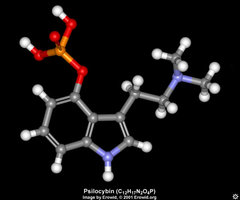
Os principais alcaloides dos cogumelos dos gêneros Psilocybe e Panaeolus, entre outros, são a psilocina (Figura 1) e a psilocibina (Figura 2).
A psilocina, que tem a nomenclatura de 4-hidroxi-N,N-dimetiltriptamina, é geralmente mais instável e menos abundante.
A psilocibina é resistente ao calor e ao ressecamento. É liberada na água de cocção (chá), que pode ser utilizada como forma de ingestão.
Aparentemente, estes alcaloides são derivados do metabolismo primário do fungo, uma vez que são encontrados em proporções aproximadamente iguais em qualquer região do mundo onde seja encontrado o fungo, o que parece indicar que sua produção não tem relação direta com estresses locais ou diferenças específicas no substrato em que ele cresce, naturalmente ou em cultivo. Esses alcaloides são encontrados tanto nos corpos frutíferos quanto no corpo vegetativo do fungo. Aparentemente o fungo sintetiza o triptofano a partir da glicose segundo o caminho de síntese no qual o ácido antranílico fornece o anel benzênico do núcleo indólico, a ribose os componentes C-2,3 e a serina a cadeia lateral de alanina.
diferentes precursores.
A triptamina origina várias outras substâncias, todas dotadas com algum grau de atividade alucinogênica. Todas as substâncias da família da psilocibina têm estas propriedades. Elas contêm a estrutura indólica básica característica da maioria dos alucinógenos encontrados na Natureza, incluindo várias amidas do ácido lisérgico (das quais o LSD é um representativo semi-sintético), N,N-dimetiltriptamina, harmina e seus análogos e ibogaína, sendo a mais notável exceção a mescalina (3,4,5-trimetoxifeniletilamina), encontrada no peyote (Lophophora williamsii, Cactaceae), portanto da mesma classe das anfetaminas (a-metilfeniletilaminas).
A principal fonte do texto é a monografia de Omar Geraldo Lopes Diniz, que pode ser lida em Usos, Bioquímica e Atividade biológica do Psilocybe Spp.
A psilocibina é um composto indólico derivado da triptamina, e tem a nomenclatura química de éster fosfato 3-[2-(Dimetilamino)etil]indol-4-ol di-hidrgênio, sendo ainda encontrada com a nomenclatura de O-fosforil-4-hidroxi-N,N-dimetiltriptamina. Tem a fórmula C12H17N2O4P; com peso molecular de 284,27. A substância pura é descrita em sua monografia em The Merck Index (op.cit.) como cristais a partir de água fervida, com ponto de derretimento a 220-228 °C, e a partir de metanol fervido com ponto de derretimento a 185-195 °C; com absorção máxima em metanol a 220, 267, 290 mm (log Î 4,6, 3,8, 3,6); pH 5,2 em solução de 50% água-etanol; solúvel em 20 partes de água fervente, 120 partes de metanol fervente; dificilmente solúvel em etanol; praticamente insolúvel em clorofórmio ou benzeno. Foi isolada por Hofmann et al em 1958, que descreveu sua estrutura e fez sua primeira revisão no Primeiro Congresso Internacional de Neurofarmacologia, em Roma, em 1958, e por Heim et al em 1959, tendo sido patenteada para a Alemanha em 1960, para os laboratórios Sandoz. Foi sintetizada por Hofmann e Troxler, tendo sido patenteada a forma sintética para os Estados Unidos em 1963, também para os laboratórios Sandoz. A psilocibina também aparece com as nomes de Fosfato de 3(2-dimetilamina) etilindol-4-oldiidrogênio e de 4-fosforiloxi-N,N-dimetiltriptamina.A psilocina, que tem a nomenclatura de 4-hidroxi-N,N-dimetiltriptamina, é geralmente mais instável e menos abundante.
A psilocibina é resistente ao calor e ao ressecamento. É liberada na água de cocção (chá), que pode ser utilizada como forma de ingestão.
Aparentemente, estes alcaloides são derivados do metabolismo primário do fungo, uma vez que são encontrados em proporções aproximadamente iguais em qualquer região do mundo onde seja encontrado o fungo, o que parece indicar que sua produção não tem relação direta com estresses locais ou diferenças específicas no substrato em que ele cresce, naturalmente ou em cultivo. Esses alcaloides são encontrados tanto nos corpos frutíferos quanto no corpo vegetativo do fungo. Aparentemente o fungo sintetiza o triptofano a partir da glicose segundo o caminho de síntese no qual o ácido antranílico fornece o anel benzênico do núcleo indólico, a ribose os componentes C-2,3 e a serina a cadeia lateral de alanina.
A biossíntese da psilocibina tem sido investigada provendo o Psilocybe cubensis com precursores marcados. Utilizando marcadores como a psilocina-3H, a 4-hidroxitriptamina-14C, a N,N-dimetiltriptamina-14C-3H, o DL triptofano-3H e outros, inclusive outros indóis marcados por troca ácida catalisada em água tritiada, chegou-se a resultados experimentais que sugerem a seguinte sequência: triptofano -> triptamina -> N-metiltriptamina -> N,N-dimetiltriptamina -> psilocina -> psilocibina. O fungo também pode converter em psilocibina a 4-hidroxitriptamina por uma rota alternativa. Foram observadas grandes diferenças na taxa de absorção dediferentes precursores.
A triptamina origina várias outras substâncias, todas dotadas com algum grau de atividade alucinogênica. Todas as substâncias da família da psilocibina têm estas propriedades. Elas contêm a estrutura indólica básica característica da maioria dos alucinógenos encontrados na Natureza, incluindo várias amidas do ácido lisérgico (das quais o LSD é um representativo semi-sintético), N,N-dimetiltriptamina, harmina e seus análogos e ibogaína, sendo a mais notável exceção a mescalina (3,4,5-trimetoxifeniletilamina), encontrada no peyote (Lophophora williamsii, Cactaceae), portanto da mesma classe das anfetaminas (a-metilfeniletilaminas).
A principal fonte do texto é a monografia de Omar Geraldo Lopes Diniz, que pode ser lida em Usos, Bioquímica e Atividade biológica do Psilocybe Spp.