Olá!!
Depois de uma semana e pouco monitorando o pote do ultimo post eu conclui que o
micélio não se desenvolveu. No quinto dia ele até estava presente no meio do substrato, mas ele não ganhou força nos últimos dias e tem um outro micélio crescendo no substrato que parece
contaminante.
Então o micélio do Pan não colonizou a tempo. Decidi então fazer um novo isolamento a partir do copo de grãos que colonizou totalmente.
Apesar de ele estar contaminado, creio que consigo isolar micélio saudável.
Inicialmente o micélio passou por cima do contaminante, mas depois o contaminante revidou. O contaminante ficou isolado num canto do copo e do outro lado tinha micélio
rizomórfico que tentei retirar para isolamento.
Vou reiniciar o processo de isolamento em placa petri usando palha novamente, só que dessa vez um pouco diferente e atento a não deixar secar demais antes de transferir para o novo substrato. Então vamos lá.
Sempre que eu trabalho com capim seco ou bosta de cavalo seca eu noto que eles soltam um pozinho bem fino. Resolvi então conseguir o máximo desse pó para utilizar como meio de cultura nas placas petri.
Primeiro eu peguei um punhado de palha e cortei manualmente o menor possível com a tesoura. Depois joguei a palha no liquidificador e bati por uns 2 minutos.
Depois passei a palha batida na peneira e juntei as menores partículas num pote. As particular maiores e mais fibrosas eu descartei. Juntei o pó de palha num copo e adicionei água e fui misturando até a palha chegar ao ponto em que ela solta algumas gotas ao ser espremida. Fechei o copo com plastico e amarrei.

Em seguida pus o copo no microondas e de 15 em 15 segundos fui esquentando ela até ela passar dos 75 graus. deixei mais 10 segundos.
Deixei o copo de lado.
Em seguida higienizei as placas petri. Depois de as secar as envolvi em alumínio e pus no forno até passar dos 130 graus e deixei por uns 20 minutos.

Enquanto a palha e as placas esfriavam eu preparei a minha SAB. Limpei ela inteira, depois passei álcool por dentro e deixei o ar assentar por 30min.
Depois peguei tudo o que precisava para fazer a transferência dos grãos para as placas e passei álcool. Em seguida pus na SAB. usei 3 colheres, uma grande uma longa e outra pequena. Usei uma placa petri cuja tampa tinha quebrado

Depois que estava tudo na SAB passei álcool em tudo de novo.
Em seguida eu tirei as placas do alumínio e retirei a tampa de plástico do copo com a palha.
Com a colher pequena eu preenchi as placas com a palha (uma placa ficou com menos do que as outras).
Em seguida eu retirei o copo da palha e a colher pequena da SAB.
O próximo passo era retirar os grãos colonizados com o micélio rizomórfico de maneira que eu não mexesse nos grãos contaminados pra não espalhar os
esporos deles pela SAB.
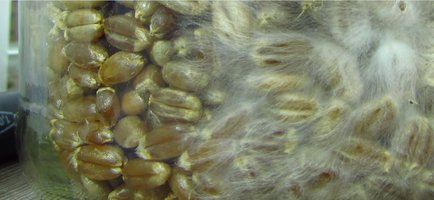
O copo estava nas seguintes condições:


A minha sorte era que o contaminante estava meio que isolado de um lado do copo e o micélio que eu queria estava do lado contrário ao do contaminante.
Decidi então retirar o micélio desta área:

Para conseguir retirar esse micélio sem mexer no contaminante eu peguei a colher grande e empurrei os grãos para um lado e a mantive firme enquanto eu retirava os grãos que queria do fundo com a colher longa. Em seguida eu pus a colherada de grãos na placa petri sem tampa. Consegui fazer o procedimento de maneira que o contaminante ficou intacto no lugar. Depois fechei e retirei da SAB o copo com os grãos. Passei álcool em todas a placas petri e em volta dos objetos também.
Depois abri placa por placa e com a colher fui colocando os grãos nas placas, passando álcool nela depois de cada procedimento.
Finalmente retirei as placas e as fechei com papel celofane.
Enfim as deixei nas mesmas condições de colonização que antes, em cima do armário pegando luz e temperatura ambiente.

O substrato do pote de sorvete que não deu certo eu vou reutilizar, vou deixar secar ao sol e usar outro dia.
É isso galera! Até mais!