Olá a todos, este é o diário de uma tentativa de domesticação de um cogumelo que foi colhido em 2010. Os carimbos estavam esquecidos e a algumas semanas os encontrei. Como não sabia nada sobre o armazenamento dos carimbos estava quase certo que eles já nem estavam mais utilizáveis, mas para tirar a dúvida contactei um amigo que me orientou a deixar a seringa descansando por um bom tempo antes de fazer uma inoculação.
(Um aviso antes de ler este diário, fique ciente que eu sou meio descuidado com assepsia e se de alguma forma isso incomodar algum membro, por favor, peço que este faça seu comentário somente depois da "raiva" passar.)
1 - SERINGA DE ESPOROS:A seringa foi preparada com 3ml de água mineral fervida e 1cm² do carimbo mais forte, a água ficou com esporos demais. Descansou por 24 horas e a agitei algumas vezes dentro deste tempo.
2 - PREPARAÇÃO DO PRIMEIRO POTE:
Coloquei o milho dentro de uma panela com água por 24 horas e após isso ele foi direto para dentro de um pote e esterilizei dentro de uma panela de pressão por apenas 20 minutos (contados após a panela começar a fazer barulho).
Fiz um pote com milho para pipoca e esperei o micélio crescer enquanto preparei mais alguns vidros com milho (tópico 4) para aumentar o micélio e ver se consigo um cultivo inicial e com os próximos carimbos pretendo fazer algo mais trabalhado.
3 - CRESCIMENTO DO MICÉLIO:
O micélio apareceu em 4 dias dentro do pote (o que me surpreendeu pois nem acreditava mais na validade dos carimbos armazenados sem cuidados).
Um pequeno ponto de contaminação foi encontrado na parte de cima do primeiro pote o que me fez abri-lo, remover o grão contaminado e espalhar alguns milhos já cobertos de micélio dentro dos outros potes (tópico 4.2).
4 - PREPARAÇÃO DOS POTES SECUNDÁRIOS:Consegui mais 5 potes iguais ao primeiro e outros menores, antes de toda a preparação pensei em algumas coisas que poderiam melhorar a qualidade do meu cultivo.
- No lugar de colocar muito milho dentro de um pote e correr o risco de contaminar uma pote inteiro eu deveria colocar somente um pouquinho de milho, para que o micélio tenha facilidade de colonizar tudo em pouco tempo.
- Posteriormente eu vou juntar os potes não contaminados num recipienta maior e fazer um casing OU ir adicionando substrato para aumentar o volume de micélio e fazer um casing dentro do próprio pote mesmo.
- Já que o micélio gosta de amido e provavelmente deve quebrar ele em "oses" menores, não seria bom alimenta-lo logo com glicose ou frutose e aumentar a velocidade de crescimento dele? Eu não pensei em nada que possa impedir isso.
- Eu moro num lugar muito quente, que tal se reduzisse a temperatura do ambiente a ponto do contaminante não conseguir de desenvolver? É que os micélios (da maioria dos cogumelos, psilocibe ou não) só aparecem espontaneamente nos pastos em épocas frias e então ele possivelmente não seria afetado pelo frio.
- Caso os potes não funcionem devo me resguardar já com um pouco de micélio no papelão.
Os potes secundários necessitaram somente da quantidade de milho que seria usado em um pote cheio. Desta vez lavei o milho, sequei coloquei tudo dentro de outra panela e adicionei água fervente, esperei 24 horas, troquei a água e fervi mais uma vez. Ficou em descanso por mais 24 horas e no final troquei a água e fervi mais uma vez antes de distribuir o milho nos potes.
4.1 - ESTERILIZAÇÃO DOS POTES SECUNDÁRIOS:
Os potes secundários foram lavados e ficaram dentro de uma bacia cheia de água e hipoclorito de sódio por algumas horas antes de serem utilizados.
4.2 - MONTAGEM E INOCULAÇÃO DOS POTES SECUNDÁRIOS:
O milho que foi fervido não foi para o processo de esterilização dentro da panela de pressão, os grão a esta altura já haviam rompido e a água fervida já tinha cozinhado quase tudo.
Antes de usar os potes ainda coloquei um pouco (pouco mesmo) de água mineral dentro de cada um e os coloquei no microondas por 3 minutos.
Distribui o milho igualmente nos potes, abri o primeiro pote e espalhei um pouco de micélio dentro de cada um dos outros potes recentes, alguns eu agitei e outros não para saber qual é o melhor método (parece que não houve diferença).
4.3 - PAPELÃO:
Separei alguns grão no papelão.
5 - ENCUBADORA:
Estão todos dentro de um isopor grande e a cada 6 horas o abro rapidamente para adicionar gelo dentro de uma garrafa PET cortada que também está lá para controlar a temperatura, pretendo arranjar uma maneira de abrir somente a cada 12 horas para fazer esta troca de gelo.
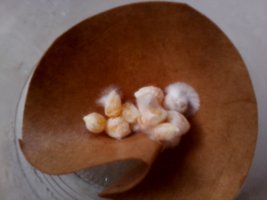
Em 48 horas os micélio está crescendo assustadoramente, eles cresceram 2cm em todas as direções no substrato e ficaram "arrepiados" com 1cm de micélio crescendo para cima, estão muito bonitos. Os que estão no papelão também estão bonitos mas não tão grandes.




Aqui as fotos do papelão em 48 horas e do aspecto do micélio em um dos potes também em 48 horas (como eu disse, ele cresce rápido e para um carimbo antigo e mal cuidado ele está me deixando muito feliz):

(Um aviso antes de ler este diário, fique ciente que eu sou meio descuidado com assepsia e se de alguma forma isso incomodar algum membro, por favor, peço que este faça seu comentário somente depois da "raiva" passar.)
1 - SERINGA DE ESPOROS:A seringa foi preparada com 3ml de água mineral fervida e 1cm² do carimbo mais forte, a água ficou com esporos demais. Descansou por 24 horas e a agitei algumas vezes dentro deste tempo.
2 - PREPARAÇÃO DO PRIMEIRO POTE:
Coloquei o milho dentro de uma panela com água por 24 horas e após isso ele foi direto para dentro de um pote e esterilizei dentro de uma panela de pressão por apenas 20 minutos (contados após a panela começar a fazer barulho).
Fiz um pote com milho para pipoca e esperei o micélio crescer enquanto preparei mais alguns vidros com milho (tópico 4) para aumentar o micélio e ver se consigo um cultivo inicial e com os próximos carimbos pretendo fazer algo mais trabalhado.
3 - CRESCIMENTO DO MICÉLIO:
O micélio apareceu em 4 dias dentro do pote (o que me surpreendeu pois nem acreditava mais na validade dos carimbos armazenados sem cuidados).
Um pequeno ponto de contaminação foi encontrado na parte de cima do primeiro pote o que me fez abri-lo, remover o grão contaminado e espalhar alguns milhos já cobertos de micélio dentro dos outros potes (tópico 4.2).
4 - PREPARAÇÃO DOS POTES SECUNDÁRIOS:Consegui mais 5 potes iguais ao primeiro e outros menores, antes de toda a preparação pensei em algumas coisas que poderiam melhorar a qualidade do meu cultivo.
- No lugar de colocar muito milho dentro de um pote e correr o risco de contaminar uma pote inteiro eu deveria colocar somente um pouquinho de milho, para que o micélio tenha facilidade de colonizar tudo em pouco tempo.
- Posteriormente eu vou juntar os potes não contaminados num recipienta maior e fazer um casing OU ir adicionando substrato para aumentar o volume de micélio e fazer um casing dentro do próprio pote mesmo.
- Já que o micélio gosta de amido e provavelmente deve quebrar ele em "oses" menores, não seria bom alimenta-lo logo com glicose ou frutose e aumentar a velocidade de crescimento dele? Eu não pensei em nada que possa impedir isso.
- Eu moro num lugar muito quente, que tal se reduzisse a temperatura do ambiente a ponto do contaminante não conseguir de desenvolver? É que os micélios (da maioria dos cogumelos, psilocibe ou não) só aparecem espontaneamente nos pastos em épocas frias e então ele possivelmente não seria afetado pelo frio.
- Caso os potes não funcionem devo me resguardar já com um pouco de micélio no papelão.
Os potes secundários necessitaram somente da quantidade de milho que seria usado em um pote cheio. Desta vez lavei o milho, sequei coloquei tudo dentro de outra panela e adicionei água fervente, esperei 24 horas, troquei a água e fervi mais uma vez. Ficou em descanso por mais 24 horas e no final troquei a água e fervi mais uma vez antes de distribuir o milho nos potes.
4.1 - ESTERILIZAÇÃO DOS POTES SECUNDÁRIOS:
Os potes secundários foram lavados e ficaram dentro de uma bacia cheia de água e hipoclorito de sódio por algumas horas antes de serem utilizados.
4.2 - MONTAGEM E INOCULAÇÃO DOS POTES SECUNDÁRIOS:
O milho que foi fervido não foi para o processo de esterilização dentro da panela de pressão, os grão a esta altura já haviam rompido e a água fervida já tinha cozinhado quase tudo.
Antes de usar os potes ainda coloquei um pouco (pouco mesmo) de água mineral dentro de cada um e os coloquei no microondas por 3 minutos.
Distribui o milho igualmente nos potes, abri o primeiro pote e espalhei um pouco de micélio dentro de cada um dos outros potes recentes, alguns eu agitei e outros não para saber qual é o melhor método (parece que não houve diferença).
4.3 - PAPELÃO:
Separei alguns grão no papelão.
5 - ENCUBADORA:
Estão todos dentro de um isopor grande e a cada 6 horas o abro rapidamente para adicionar gelo dentro de uma garrafa PET cortada que também está lá para controlar a temperatura, pretendo arranjar uma maneira de abrir somente a cada 12 horas para fazer esta troca de gelo.
Em 48 horas os micélio está crescendo assustadoramente, eles cresceram 2cm em todas as direções no substrato e ficaram "arrepiados" com 1cm de micélio crescendo para cima, estão muito bonitos. Os que estão no papelão também estão bonitos mas não tão grandes.




Aqui as fotos do papelão em 48 horas e do aspecto do micélio em um dos potes também em 48 horas (como eu disse, ele cresce rápido e para um carimbo antigo e mal cuidado ele está me deixando muito feliz):


Última edição por um moderador:











