- 12/08/2011
- 25
- 49
Como estava bastante interessado no cultivo de trufas, dei uma estudada no tópico supracitado e decidi fazer a tradução para compartilhar o conhecimento com todos daqui. Também traduzi uma pequena passagem de outro tópico por achar que esse texto carecia dessa informação. Espero que possa ajudá-los e desculpem qualquer erro.
Autor: stonesun (shroomery)
Fonte: http://www.shroomery.org/forums/showflat.php/Number/13431948
Título: Um Guia Abrangente de Cultivo de Esclerotia - de carimbo a carimbo
“Decidi colocar este guia sobre o cultivo de Psilocybes sclerotia porque há inúmeros tópicos velhos e ultrapassados flutuando por aqui. No entanto, existem também ótimos tópicos como, “Easier than Cubes! ” ou “Sclerotia FAQ”. Ambos são ótimas leituras, altamente recomendadas. Tentarei cobrir as espécies mais populares e prontamente disponíveis:
- Psilocybe galindoi / ATL # 7
- Psilocybe mexicana / A
- Psilocybe tampanensis / Pollock
- Psilocybe mexicana / Jalisco
Eu tenho trabalhado principalmente com esses quatro produtores de esclerotia; o grupo Mexicanae é o meu favorito absoluto do gênero Psilocybe. Como você provavelmente já sabe, essas espécies têm a capacidade tanto de produzir esclerotia in vitro como corpos frutíferos. A maioria das pessoas os cultiva apenas pelas esclerotia, porém espero que depois de ler este, mudem de idéia e dêem-lhe chances também, de frutificar. Eles não são muito mais difíceis de frutificar que P. Cubensis requerem apenas uma fina camada de casing e um pouco mais de carinho, amor e cuidado. Vamos começar!
Grãos / Preparação do Substrato FAI (do mais ao menos funcional)
- Grãos de centeio
- Semente de grama de centeio (SGC)
- Mistura de sementes para pássaros (MSP)
- Farinha de arroz integral (FAI)
Não irei entrar em detalhes sobre a preparação de FAI, MSP e SGC porque esses três métodos são definitivamente inferiores a um substrato de grão de centeio perfeitamente preparado.
Aqui vai uma pequena versão desses três:
- FAI:
A preparação dos bolos é a formula regular (1:1:2 – BRF:água:vermiculita), porém ao invés de 100% de água, use uma solução de 50% água + 50% café. Esterilizar a vapor por 90min ou PP por 60min com 15psi.
Esclerótia de P. tampanensis formando no substrato FAI.



- SGC (jarra de 1qt. aprox. 946ml):
300ml de CGC
Mistura de café / água (50/50)
Uma pitada de gipsita
Coloque o CGC e o gipsita na sua jarra, e então despeje o café / água sobre ele. Agite para distribuir o liquido uniformemente e deixe-o descansar por duas horas. Em seguida então esterilize em PP por 60min com 15psi.
Esclerótia de P. galindoi em SGC.



- MSP:
Pessoalmente eu odeio MSP porque é confuso e muito difícil limpar o milho, no entanto use-o se por algum razão centeio ou SGC não estiverem disponíveis. Você também pode prepará-la da mesma forma como os grãos de centeio abaixo.
Colonização de P. Tampanensis na MSP.


- Grãos de centeio
Quanto aos grãos de centeio, aqui está um método de preparação detalhado e ilustrado.
Eu começo fazendo 2qt. (aprox. 1842ml) de café forte.
Em uma panela grande aqueça entre 2 - 2,5 galões de água (aprox. 7,6 – 9,5 litros) e adicione o café.
Adicione duas colheres de chá de gipsita e mexa.
Prepararando o molho de café / água



Enquanto o café / água é aquecido, meça o centeio. Use uma xícara de centeio para cada jarra de 1qt.
Enxágüe os grãos algumas vezes para limpá-los de toda a sujeira / detritos. Quando a água que sai do enxágüe estiver clara, escorra os grãos.
Assim que a temperatura do café / água alcançar 160°F (aprox. 70°C) apague o fogo e despeje os grãos. Mexa e deixe-os descansar por um período de 4-24 horas.
Pessoalmente, faço isso durante a noite, com um tempo de imersão de 8 a 10 horas.
Lavando o centeio e adicionando-o ao café / água



Seu centeio estará saturado de café / água, agora é hora de fervê-los.
Leve a mistura a fervura e deixe-os assim entre 10 e 15min.
Desligue o fogo, coe os grãos e deixei-os esfriar (eu gosto de colocar um ventilador sobre eles e movê-los algumas vezes durante a secagem).
Certifique-se que a superfície dos grãos esteja completamente seca.
Fervendo, coando e secando dos grãos de centeio



Agora eles estão prontos para carregar os frascos.
Use seu tipo favorito de tampas e filtros.
Ex: 1 camada de filtro de café + 2 camadas de papel alumínio.
Enchendo os frascos e fechando-os com tampa e papel alumínio



Esterilize em PP por pelo menos 90min (eu gosto de deixar 120min) com 15psi.
Como sempre, deixe a PP esfriar completamente antes de retirar os frascos.
Os grãos ficam um pouco compactados após a esterilização por isso gosto de agitá-los suavemente após retirá-los da PP.
Pronto para inoculação.
Frascos antes e depois da esterilização



Métodos de inoculação:
Você deve ter um carimbo ou uma seringa de esporos. Se você não quer complicar as coisas, vá em frente e inocule o substrato com a seringa de esporos. Se você tiver um carimba, você já sabe, basta fazer uma seringa de esporos.
Carimbos e seringa de esporos de P. mexicana



Se você já possui um conhecimento um pouco avançado e faz CL’s para seus cubensis, estas espécies se dão muito bem com CL’s Extrato de Malte e Dextrose. Use sua receita favorita. A minha é 1 colher de chá de extrato de malte e 1/8 de dextrose por litro.
O melhor e mais avançado método, no entanto, é iniciar seus esporos em ágar.
Micélio de P. galindoi CL EM/ DEX



Quando você tiver um crescimento bom e saudável em seus petri dishes (não vou entrar em detalhes sobre isolamentos), você poderá inocular o substrato de grãos.
P. galindoi e P. mexicana em ágar

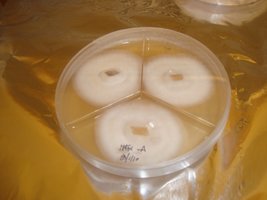
Centeio inoculado com ágar



Agora é só organizá-los e esquecê-los.
Vocês esta pronto para algumas trufas?
Muitas vezes (especialmente com esporos e inoculação com ágar) a esclerotia vai formar-se antes da colonização total do substrato. Isto é perfeitamente normal.
Se você inocular com CL, o micélio apenas colonizara o substrato e as pedras se formarão após 100% de colonização.
De qualquer modo você verá esclerótias em breve.
Agora é só incubá-los e esquecê-los!
Você está pronto para algumas trufas?
Alguns jarras ‘jovens’ (menos de 30 dias)



Existem controvérsias sobre agitar ou não os potes quando estiverem de 20% a 30% colonizados. Alguns dizem que tudo bem, outros dizem para não fazê-lo. Já obtive sucesso com essa técnica, mas também já falhei algumas vezes, portanto eu não agito mais.
Quando quero expandir o cultivo e planejo fazer uma transferência grain to grain (grão para grão), na minha experiência, o melhor método e iniciar com CL.
Eu uso 3 a 4cc por frasco e o desenvolvimento sempre se inicia dentro de uma semana. As esclerotias ainda não estarão se formando ou se estiverem, estarão muito pequenas.
Como sempre, quebre seus grãos colonizados através da agitação dos frascos e faça a transferência para novos frascos de substrato esterilizado.
No entanto, se você possui uma boa quantidade de CL, eu prefiro ir por esse caminhos ao invés de grain to grain.
P. mexicana/A - jarras de centeio com cerca de 60 dias



P. galindoi - frascos de centeio com cerca de 60 dias



Colheita das Esclerotias:
Bem, é hora de apreciar os primeiros ‘frutos’ de seu trabalho.
Quando você chega a este estágio, o pote deve ter 2 meses ou mais. Não existe ponto de colheita antes dos 2 meses (minha última safra foi de 6 meses), alguns deixam mais tempo mas sempre precisamos de frascos / espaço.
Continuando, obtenha uma colher e higienize-a com álcool; raspe e separe o substrato das esclerotias em uma folha de alumínio. Já fiz isso tanto em capela de fluxo laminar quanto em ar totalmente aberto e nunca tive problemas de contaminação.
Trufas colhidas de bolos de SGC e grãos de centeio



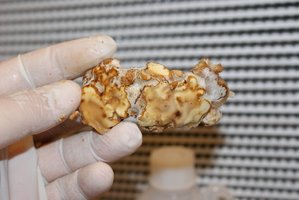
Limpe suas esclerotias com uma escova de cerdas macias e armazene-as frescas em sacos de papel dentro da geladeira, para conservá-las por algumas semanas ou desidrate-as (mesmo método usado com PC) para conservá-las por meses.
Esclerotia de P. mexicana/A colhidas em grãos de centeio


Continua

Autor: stonesun (shroomery)
Fonte: http://www.shroomery.org/forums/showflat.php/Number/13431948
Título: Um Guia Abrangente de Cultivo de Esclerotia - de carimbo a carimbo
“Decidi colocar este guia sobre o cultivo de Psilocybes sclerotia porque há inúmeros tópicos velhos e ultrapassados flutuando por aqui. No entanto, existem também ótimos tópicos como, “Easier than Cubes! ” ou “Sclerotia FAQ”. Ambos são ótimas leituras, altamente recomendadas. Tentarei cobrir as espécies mais populares e prontamente disponíveis:
- Psilocybe galindoi / ATL # 7
- Psilocybe mexicana / A
- Psilocybe tampanensis / Pollock
- Psilocybe mexicana / Jalisco
Eu tenho trabalhado principalmente com esses quatro produtores de esclerotia; o grupo Mexicanae é o meu favorito absoluto do gênero Psilocybe. Como você provavelmente já sabe, essas espécies têm a capacidade tanto de produzir esclerotia in vitro como corpos frutíferos. A maioria das pessoas os cultiva apenas pelas esclerotia, porém espero que depois de ler este, mudem de idéia e dêem-lhe chances também, de frutificar. Eles não são muito mais difíceis de frutificar que P. Cubensis requerem apenas uma fina camada de casing e um pouco mais de carinho, amor e cuidado. Vamos começar!
Grãos / Preparação do Substrato FAI (do mais ao menos funcional)
- Grãos de centeio
- Semente de grama de centeio (SGC)
- Mistura de sementes para pássaros (MSP)
- Farinha de arroz integral (FAI)
Não irei entrar em detalhes sobre a preparação de FAI, MSP e SGC porque esses três métodos são definitivamente inferiores a um substrato de grão de centeio perfeitamente preparado.
Aqui vai uma pequena versão desses três:
- FAI:
A preparação dos bolos é a formula regular (1:1:2 – BRF:água:vermiculita), porém ao invés de 100% de água, use uma solução de 50% água + 50% café. Esterilizar a vapor por 90min ou PP por 60min com 15psi.
Esclerótia de P. tampanensis formando no substrato FAI.



- SGC (jarra de 1qt. aprox. 946ml):
300ml de CGC
Mistura de café / água (50/50)
Uma pitada de gipsita
Coloque o CGC e o gipsita na sua jarra, e então despeje o café / água sobre ele. Agite para distribuir o liquido uniformemente e deixe-o descansar por duas horas. Em seguida então esterilize em PP por 60min com 15psi.
Esclerótia de P. galindoi em SGC.



- MSP:
Pessoalmente eu odeio MSP porque é confuso e muito difícil limpar o milho, no entanto use-o se por algum razão centeio ou SGC não estiverem disponíveis. Você também pode prepará-la da mesma forma como os grãos de centeio abaixo.
Colonização de P. Tampanensis na MSP.


- Grãos de centeio
Quanto aos grãos de centeio, aqui está um método de preparação detalhado e ilustrado.
Eu começo fazendo 2qt. (aprox. 1842ml) de café forte.
Em uma panela grande aqueça entre 2 - 2,5 galões de água (aprox. 7,6 – 9,5 litros) e adicione o café.
Adicione duas colheres de chá de gipsita e mexa.
Prepararando o molho de café / água



Enquanto o café / água é aquecido, meça o centeio. Use uma xícara de centeio para cada jarra de 1qt.
Enxágüe os grãos algumas vezes para limpá-los de toda a sujeira / detritos. Quando a água que sai do enxágüe estiver clara, escorra os grãos.
Assim que a temperatura do café / água alcançar 160°F (aprox. 70°C) apague o fogo e despeje os grãos. Mexa e deixe-os descansar por um período de 4-24 horas.
Pessoalmente, faço isso durante a noite, com um tempo de imersão de 8 a 10 horas.
Lavando o centeio e adicionando-o ao café / água



Seu centeio estará saturado de café / água, agora é hora de fervê-los.
Leve a mistura a fervura e deixe-os assim entre 10 e 15min.
Desligue o fogo, coe os grãos e deixei-os esfriar (eu gosto de colocar um ventilador sobre eles e movê-los algumas vezes durante a secagem).
Certifique-se que a superfície dos grãos esteja completamente seca.
Fervendo, coando e secando dos grãos de centeio



Agora eles estão prontos para carregar os frascos.
Use seu tipo favorito de tampas e filtros.
Ex: 1 camada de filtro de café + 2 camadas de papel alumínio.
Enchendo os frascos e fechando-os com tampa e papel alumínio



Esterilize em PP por pelo menos 90min (eu gosto de deixar 120min) com 15psi.
Como sempre, deixe a PP esfriar completamente antes de retirar os frascos.
Os grãos ficam um pouco compactados após a esterilização por isso gosto de agitá-los suavemente após retirá-los da PP.
Pronto para inoculação.
Frascos antes e depois da esterilização



Métodos de inoculação:
Você deve ter um carimbo ou uma seringa de esporos. Se você não quer complicar as coisas, vá em frente e inocule o substrato com a seringa de esporos. Se você tiver um carimba, você já sabe, basta fazer uma seringa de esporos.
Carimbos e seringa de esporos de P. mexicana



Se você já possui um conhecimento um pouco avançado e faz CL’s para seus cubensis, estas espécies se dão muito bem com CL’s Extrato de Malte e Dextrose. Use sua receita favorita. A minha é 1 colher de chá de extrato de malte e 1/8 de dextrose por litro.
O melhor e mais avançado método, no entanto, é iniciar seus esporos em ágar.
Micélio de P. galindoi CL EM/ DEX



Quando você tiver um crescimento bom e saudável em seus petri dishes (não vou entrar em detalhes sobre isolamentos), você poderá inocular o substrato de grãos.
P. galindoi e P. mexicana em ágar


Centeio inoculado com ágar



Agora é só organizá-los e esquecê-los.
Vocês esta pronto para algumas trufas?
Muitas vezes (especialmente com esporos e inoculação com ágar) a esclerotia vai formar-se antes da colonização total do substrato. Isto é perfeitamente normal.
Se você inocular com CL, o micélio apenas colonizara o substrato e as pedras se formarão após 100% de colonização.
De qualquer modo você verá esclerótias em breve.
Agora é só incubá-los e esquecê-los!
Você está pronto para algumas trufas?
Alguns jarras ‘jovens’ (menos de 30 dias)



Existem controvérsias sobre agitar ou não os potes quando estiverem de 20% a 30% colonizados. Alguns dizem que tudo bem, outros dizem para não fazê-lo. Já obtive sucesso com essa técnica, mas também já falhei algumas vezes, portanto eu não agito mais.
Quando quero expandir o cultivo e planejo fazer uma transferência grain to grain (grão para grão), na minha experiência, o melhor método e iniciar com CL.
Eu uso 3 a 4cc por frasco e o desenvolvimento sempre se inicia dentro de uma semana. As esclerotias ainda não estarão se formando ou se estiverem, estarão muito pequenas.
Como sempre, quebre seus grãos colonizados através da agitação dos frascos e faça a transferência para novos frascos de substrato esterilizado.
No entanto, se você possui uma boa quantidade de CL, eu prefiro ir por esse caminhos ao invés de grain to grain.
P. mexicana/A - jarras de centeio com cerca de 60 dias



P. galindoi - frascos de centeio com cerca de 60 dias



Colheita das Esclerotias:
Bem, é hora de apreciar os primeiros ‘frutos’ de seu trabalho.
Quando você chega a este estágio, o pote deve ter 2 meses ou mais. Não existe ponto de colheita antes dos 2 meses (minha última safra foi de 6 meses), alguns deixam mais tempo mas sempre precisamos de frascos / espaço.
Continuando, obtenha uma colher e higienize-a com álcool; raspe e separe o substrato das esclerotias em uma folha de alumínio. Já fiz isso tanto em capela de fluxo laminar quanto em ar totalmente aberto e nunca tive problemas de contaminação.
Trufas colhidas de bolos de SGC e grãos de centeio



Limpe suas esclerotias com uma escova de cerdas macias e armazene-as frescas em sacos de papel dentro da geladeira, para conservá-las por algumas semanas ou desidrate-as (mesmo método usado com PC) para conservá-las por meses.
Esclerotia de P. mexicana/A colhidas em grãos de centeio



Continua


















































































