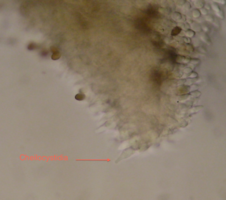
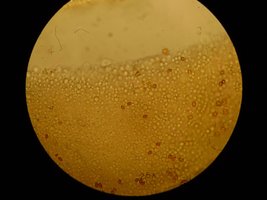
Todas os carimbos foram recebidos da Pró-fungos.
Preparação do trigo:
Num pote grande lavei os grãos cobrindo com água, agitando e retirando os que boiam e as cascas. No mesmo pote fica tudo coberto com água destilada ou mineral pois a água daqui sempre sai muito clorada, por 24hs. Escorri tudo numa peneira grande e lavei com água abundante, e em seguida movimentos de subida na peneira com os grãos, para escorrer mais rápido e muito bem. Preencho 2/3 dos potes, coloco a tampa sem fechar completamente e o papel alumínio dobrado em dois fazendo uma saia por cima. Como eu sempre falo a água tem que ficar dentro do grão não fora.
Suspensão de esporos:
Em fluxo laminar, usando tubos com tampa que já foram autoclavados com água destilada dentro pego esporos da porção central do carimbo com um swab estéril molhado com água do próprio tubo e transfiro de volta para dentro do tubo.
Por descuido esqueci os tubos fora da geladeira num final de semana e os esporos germinaram todos dentro dos tubos, com exceção do Redboy.
Os 3 potes com trigo estão com P.S. Thai KSSS:

Enquanto isso brinco com algumas placas:
Meios:
Ágar-maltose (para 1l):
30g de dextrose
3g de peptona
15 de ágar
PDA (para 1l)
Infusão de 200g de batatas em 1l de água, por 30min, filtrada em gaze.
20g de dextrose
20g de ágar
Placas PDA:



Contaminação por Streptobacillus sp:
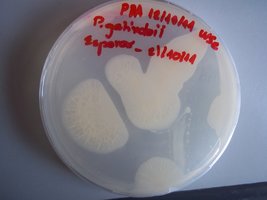
Placas AMP:
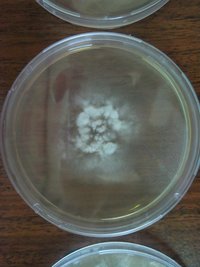
Contaminação por Penicillium sp:
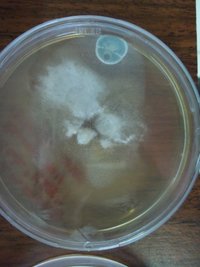
Placa com P.C. Mexican que foram transferidas para PDA:

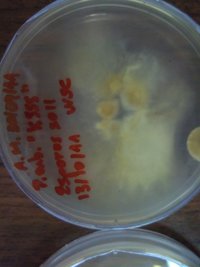
Dá para notar uma diferença clara no cultivo com PDA e com AMP; no AMP o micélio talvez por ter mais acesso a aminoácidos do que no PDA começa logo a produzir psilocibina/psilocina e azula, além de formar esse micélio com cor de cogumelo, meio caramelo.
Autoclave a 124.2C:

Só para testar fiz os meios sem ágar (meio líquido), foi só um teste, cultivei uma transferência do P.C. Mex. em agitação por 3 dias e descartei. Funciona bem, principalmente com troca de ar na superfície e agitação constante. É mais seguro pois dá para garantir que se está pegando um pedaço de ágar com micélio não contaminado (ou alguma outra coisa colonizada) e mais rápido do que com esporos. Usei um Erleymeyer com agitador magnético, mas dá para usar um vidro qualquer com tampa/micropore e agitação manual.
Qualquer dúvida perguntem aí.
Preparação do trigo:
Num pote grande lavei os grãos cobrindo com água, agitando e retirando os que boiam e as cascas. No mesmo pote fica tudo coberto com água destilada ou mineral pois a água daqui sempre sai muito clorada, por 24hs. Escorri tudo numa peneira grande e lavei com água abundante, e em seguida movimentos de subida na peneira com os grãos, para escorrer mais rápido e muito bem. Preencho 2/3 dos potes, coloco a tampa sem fechar completamente e o papel alumínio dobrado em dois fazendo uma saia por cima. Como eu sempre falo a água tem que ficar dentro do grão não fora.
Suspensão de esporos:
Em fluxo laminar, usando tubos com tampa que já foram autoclavados com água destilada dentro pego esporos da porção central do carimbo com um swab estéril molhado com água do próprio tubo e transfiro de volta para dentro do tubo.
Por descuido esqueci os tubos fora da geladeira num final de semana e os esporos germinaram todos dentro dos tubos, com exceção do Redboy.
Os 3 potes com trigo estão com P.S. Thai KSSS:

Enquanto isso brinco com algumas placas:
Meios:
Ágar-maltose (para 1l):
30g de dextrose
3g de peptona
15 de ágar
PDA (para 1l)
Infusão de 200g de batatas em 1l de água, por 30min, filtrada em gaze.
20g de dextrose
20g de ágar
Placas PDA:



Contaminação por Streptobacillus sp:

Placas AMP:

Contaminação por Penicillium sp:

Placa com P.C. Mexican que foram transferidas para PDA:


Dá para notar uma diferença clara no cultivo com PDA e com AMP; no AMP o micélio talvez por ter mais acesso a aminoácidos do que no PDA começa logo a produzir psilocibina/psilocina e azula, além de formar esse micélio com cor de cogumelo, meio caramelo.
Autoclave a 124.2C:

Só para testar fiz os meios sem ágar (meio líquido), foi só um teste, cultivei uma transferência do P.C. Mex. em agitação por 3 dias e descartei. Funciona bem, principalmente com troca de ar na superfície e agitação constante. É mais seguro pois dá para garantir que se está pegando um pedaço de ágar com micélio não contaminado (ou alguma outra coisa colonizada) e mais rápido do que com esporos. Usei um Erleymeyer com agitador magnético, mas dá para usar um vidro qualquer com tampa/micropore e agitação manual.
Qualquer dúvida perguntem aí.