P
Phyllomedusa
Visitante
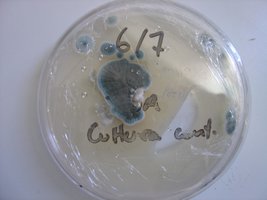
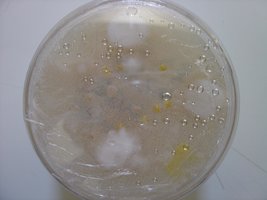
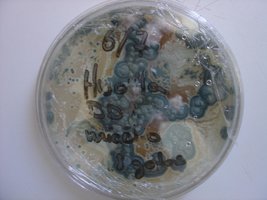
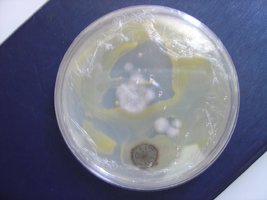
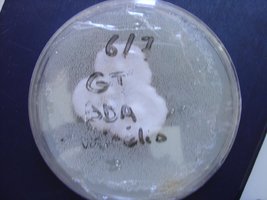
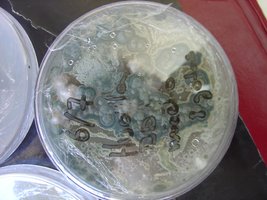
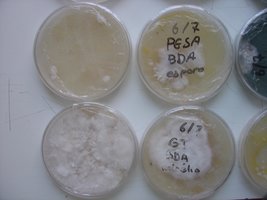
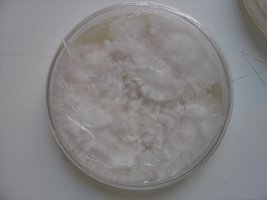
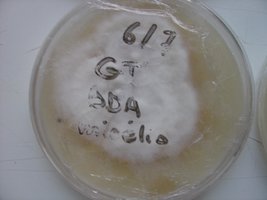
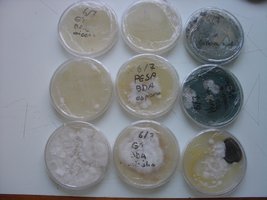
Esses dias preparei 10 placas de petri com Batata, dextrose e agar e inoculei com 3 variedades de cubensis (GT, Huatla e PESA). 4 placas estao visivelmente contamidas (talvez aspergillus e outras coisas verdes):neg: . Essa ai nao apareceu nada verde apenas isso. Voces acham que é micélio?
A variedade é GT. Foi inoculada a partir de uma cultura de micelio em meio liquido.
A foto nao está muito boa porque a placa condensou.
Abraços!
*Depois posto as fotos das contaminaçoes!

A variedade é GT. Foi inoculada a partir de uma cultura de micelio em meio liquido.
A foto nao está muito boa porque a placa condensou.
Abraços!
*Depois posto as fotos das contaminaçoes!