- 26/10/2014
- 7
- 12
- 35
Saudações comunidade Cogumelos Mágicos!
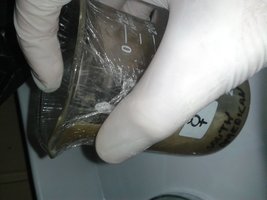
É uma honra e um prazer usufruir deste espaço para compartilhar com vocês este experimento que estou a realizar desde domingo, dia 22. Naquele dia, comecei preparando o meio de cultura BDA, seguindo a receita tradicional (caldo de batata, xarope de glicose e agar-agar) e depois esterilizei três plaquinhas de Petri na panela de pressão, embaladas em papel toalha. Quando fria, levei a autoclave improvisada para junto da minha poor man's glovebox. Ela consiste num organizador plástico furado com tubos de PVC onde se encaixam luvas, a tampa vedada com filme plástico, modelo bem conhecido. Já havia sido previamente desinfetada e mandei o embrulho estéril lá pra dentro. Este, depois da panela de pressão, se apresentou encharcado.Anteriormente não tive bons resultados vertendo meio de cultura em placas úmidas: as gotículas de água na tampa dificultam a visão, isso quando o excesso de água não fica sobrenadante ao meio de cultura, o que parece dificultar para o micélio. Sendo assim, desembrulhei-as e as deixei abertas dentro da glovebox pra água evaporar. Somente na terça, 23, as benditas cápsulas de vidro vieram a ficar bem secas. Na tarde deste dia, esterilizei o meio de cultura (que pacientemente aguardava sob refrigeração): 20 minutos na panela de pressão a partir da fervura. Esperei esfriar, levei pra perto da caixa, abri a panela, peguei o frasco com o meio e mandei rapidão pra dentro dela, rezando pra que o ar externo que entrou ali, dadas as limitações do set up, não viesse carregando nenhum contaminante.
Tudo lá dentro, inclusive o inóculo, sentei-me confortavelmente, calcei as luvas... me ocorreu que ao elaborar o meio devo ter pesado um pouco a mão no ágar
Então as placas inoculadas ficaram aguardando dentro da glovebox até a manhã do dia seguinte, quarta, 25, quando foram expostas às condições de incubação (33°C aproximadamente) e assim permanecem até o presente momento.
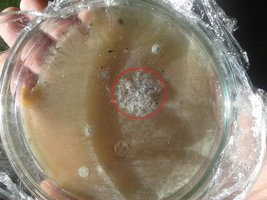
Chamou-me atenção o rápido desenvolvimento da rede micelial na placa que recebeu os esporos selvagens, que após um dia de inoculação e menos de um dia de incubação já apresenta algum rizomorfismo visível, conforme imagem em anexo.
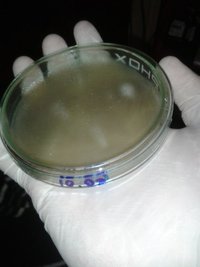
 As placas de South American ainda não mostram sinais de desenvolvimento.
As placas de South American ainda não mostram sinais de desenvolvimento.Por enquanto é isso, pessoal, tentei ser sucinto mas já escrevi um montão. :roflmao: Aos que já trabalharam com South American, qual o truque? Esta é a terceira vez que tento germinar esporos dessa strain, anteriormente sem sucesso.
[EDIT 26/02/15]
Então galera, hoje, após 24h de incubação, as placas de South American continuam sem apresentar desenvolvimento micelial, porém, não mencionei isso antes, o copo béquer usado para esterilizar o BDA em cuja superfície interna ficou uma boa quantidade de meio de cultura também foi inoculado com South American, da mesma forma e na mesma ocasião que es placas. Nele, sim, já é possível distinguir micélio na lateral, avançando para colonizar as demais áreas. Segue uma imagem:
 Tenho um palpite, penso que isso esteja relacionado com a capacidade do copo em reter mais oxigênio que as placas de Petri, o que vocês acham?
Tenho um palpite, penso que isso esteja relacionado com a capacidade do copo em reter mais oxigênio que as placas de Petri, o que vocês acham?
Última edição: