- 07/07/2020
- 1
- 2
- 30
Depois da falha catastrófica do meu primeiro cultivo devido a tecnicas impróprias (na hora de colonizar o substrato meu cultivo foi todo tomado por Schizophyllum Commune) eu decidi me aventurar com agar, o que também não deu certo de primeira e não foi por falta de pesquisar, então venho relatar o que deu certo e como fiz ja que os resultados com agar culinário são muito distoantes do que vemos das receitas gringas. Depois de 4 dias cozinhando agar que nem um louco e 20 placas de petri jogadas no lixo aqui vai minha experiência.
A não ser que seja Agar importado (as marcas asiáticas tem desempenho melhor) a quantidade varia muito do que vemos por ai nos tutoriais, vou começar por recomendações básicas:
Primeiramente gostaria de deixar claro que a pesagem que estou utilizando é aproximada, não tenho balanças portanto para saber quanto de agar eu estava usando optei por colheres de medida (padrão métrico). A densidade do agar em pó é praticamente a mesma da gelatina em pó, portanto peso em relação as medidas das colheres são os seguintes:
*tsp = Teaspoon, Colher de chá
*Tbsp = Tablespoon, Colher de sopa
Minha primeira tentativa de sucesso foi com Agua de flocos de aveia, acabei esgotando meu estoque de batatas no meio da experimentação e precisava de um substituto rápido. O processo que usei:
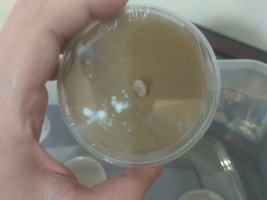
Primeiro eu misturei os ingredients em pó e depois adicionei 150ml de agua filtrada escaldante, depois misturei esse liquido com 100ml de água de aveia coada e fervida por 5 minutos. Com os ingredientes misturados, eu continuei misturando por 2 minutos em fogo baixo até perceber uma mistura homogenea, mas notei que a mistura ficou um pouco pastosa demais, e adicionei um pouco de água (uns 50ml) e deu uma melhorada. Depois disso tudo coloquei na panela de pressão por 20 minutos (apos ganhar pressão constante) e esperei resfriar. Suspeitei que a formação de placa e pelotas após a esterilização tenha a ver com: quantidade de agua, quantidade de Agar ou a velocidade de resfriamento do meio, ja que utilizei uma garrafa de whisky bem grossa.
Resultado: Agar bem pastoso depois que esfria, boa consistencia mas devemos nos atentar a quantidade, tive sucesso com medidas entre 8.5 pra um agar mais claro e 9.5 pra um mais pastoso. Nenhum deles atingem aquela dureza de plástico, fica parecendo um silicone levemente humido ou uma gelatina mais firme.
Considerações finais e experimentos futuros: Pretendo repetir o experimento melhorando a tecnica de mistura para ter certeza se é uma questão de proporção água/agar a formação de pelotas. Logo no dia que obtive sucesso, minha encomenda de extrato de malte (DME) chegou, também testarei com DME e Agua de batata, sei que agua de aveia tem bastante amido e quero verificar o quanto isso influencia na solidificação de agar comercial.
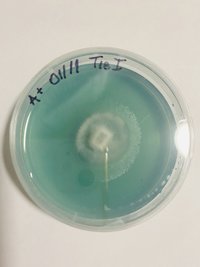
Resultados da Inoculação das placas: Eu fiz 5 placas e transferi grãos germinados para 3, duas dia 09/07 e uma hoje, dois dias atrás as duas placas estavam como a de hoje. Notei rápido crescimento sendo que a inoculação foi feita apartir de esporos que germinaram em arroz integral e estavam demorando uma eternidade para espalhar. Vamos ver se o agar se mantem firme e se a quantidade de nutrientes está adequada no decorrer dos dias.

Atualização (14/07):
Finalmente pude testar algumas placas com agar MEA (de extrato de malte), ai vão as proporções
Percebi que uma boa forma de misturar o liquido é usar um batedor de bolo (manual) em fogo baixo, na minha segunda tentativa com MEA (a primeira escorregou malandramente de minhas mãos para a pia) eu percebi que esta técnica deixou o agar mais claro e homogeneo.
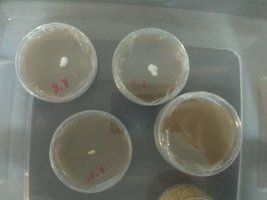
Resultados: Um agar homogeneo, claro (o mais claro que consegui com uma marca culinária) e um pouco mais mais resistente que o anterior, consistencia bem parecida com um silicone. A homogeneidade e clareza desse agar facilita muito mais a identificação de agentes contaminantes.
Logo quando transferi para os pratos de MEA ja pude observar na pratica os resultados de um agar claro e homogeneo, o prato pintado nos resultados dessa leva aparentemente está contaminado (a condesação na tampa não tem forma típica). O resto dos inoculados tem uma fina circumferencia em volta do micelio, vou esperar alguns dias caso seja consendação. No mais essas proporções me renderam bons resultados a um preço acessível, o problema agora é sanitário (casa antiga e cheia de mofo), ironicamente estou tendo problemas com bactérias e não mofo.


A não ser que seja Agar importado (as marcas asiáticas tem desempenho melhor) a quantidade varia muito do que vemos por ai nos tutoriais, vou começar por recomendações básicas:
- Não filtre a mistura com agar: pode parecer intuitivo filtrar os sedimentos, mas percebi que os sedimentos mais grossos tendem a dissolver durante a esterilização. Filtrar a mistura costuma deixar a solução mais fina, em agares culinários isso dificulta um pouco a solidificação.
- Teste a dissolução do seu agar: Muitos lugares recomendam técnicas diferentes pra dissolver a formação de pelotas na mistura. Dissolver em água fria ou água quente? Despejar aos poucos? Recomendo que teste as três formas numa quantidade menor de agar e veja qual funciona melhor pro seu caso, obtive resultados diferentes com marcas diferente, os melhores foram com uma marca de uma loja cerealista local. Pessoalmente eu obtive bons resultados dissolvendo o agar em agua quente, no fogo baixo e misturando de 3 a 5 minutos até obter uma consistência homogenea.
- Teste antes de esterilizar: Se eu tivesse testado o agar antes de esterilizar, eu não teria perdido tempo, gás e 20 placas de petri atoa. Ainda mais que os miseros 20-30 minutos de esterilização parecem uma eternidade quando você está repetindo o processo várias vezes num periodo de dias. Assim que a mistura estiver pronta, cabe testá-la numa placa separada somente para isto, a esterilização na panela de pressão altera um pouco a consistencia, mas o teste serve pra te dar uma ideia geral do resultado.
- Utilize um medium de esterilização apropriado: Pode parecer besteira, mas o recipiente usado durante a esterilização é importante. Potes de conserva são muito convenientes mas apresentam uma série de desvantagens como a boca larga (maior probabilidade de contaminação durante o derramar do Agar), dificuldade em abrir (as tampas selam com facilidade e a borrracha vai desgastando com o uso) e outras coisas mais como dificuldade de manuseio dentro de uma caixa de ár parado. Dêem preferências para garrafas, elas resolvem todos os problemas acima. Pessoalmente obtive recente sucesso com garrafas de reagente, são apropriadas pra esterilização, a tampa vai tranquilo na panela de pressão e tem o bonus de serem graduadas.
- Preste atenção no tempo de esterilização: Se estiver usando malte, atente se ao tempo de esterilização, percebi que passar da marca dos 20 minutos não é uma boa ideia quando se usa malte. Os açucares tendem a caramelizar, tive essa experiencia na casa de um amigo.
- Incremente de maneira consistente: Se não souber a dosagem certa, experimente aumentar a quantidade em incrementos de 1.5 a 2g, percebi uma diferença visível utilizando estes incrementos em agares comerciais de diferentes origens.
Primeiramente gostaria de deixar claro que a pesagem que estou utilizando é aproximada, não tenho balanças portanto para saber quanto de agar eu estava usando optei por colheres de medida (padrão métrico). A densidade do agar em pó é praticamente a mesma da gelatina em pó, portanto peso em relação as medidas das colheres são os seguintes:
*tsp = Teaspoon, Colher de chá
*Tbsp = Tablespoon, Colher de sopa
Medida | Peso Aproximado |
|---|---|
0.5 tsp | 1.59g |
1.0 tsp | 3.20g |
0.5 Tbsp | 4.76g |
1.0 Tbsp | 9.51g |
Quantidade | Ingrediente |
|---|---|
1 Tbsp | Agar |
1.5 tsp | |
100ml | Agua de aveia |
150ml | Água filtrada |
Resultado: Agar bem pastoso depois que esfria, boa consistencia mas devemos nos atentar a quantidade, tive sucesso com medidas entre 8.5 pra um agar mais claro e 9.5 pra um mais pastoso. Nenhum deles atingem aquela dureza de plástico, fica parecendo um silicone levemente humido ou uma gelatina mais firme.
Considerações finais e experimentos futuros: Pretendo repetir o experimento melhorando a tecnica de mistura para ter certeza se é uma questão de proporção água/agar a formação de pelotas. Logo no dia que obtive sucesso, minha encomenda de extrato de malte (DME) chegou, também testarei com DME e Agua de batata, sei que agua de aveia tem bastante amido e quero verificar o quanto isso influencia na solidificação de agar comercial.
Resultados da Inoculação das placas: Eu fiz 5 placas e transferi grãos germinados para 3, duas dia 09/07 e uma hoje, dois dias atrás as duas placas estavam como a de hoje. Notei rápido crescimento sendo que a inoculação foi feita apartir de esporos que germinaram em arroz integral e estavam demorando uma eternidade para espalhar. Vamos ver se o agar se mantem firme e se a quantidade de nutrientes está adequada no decorrer dos dias.


Atualização (14/07):
Finalmente pude testar algumas placas com agar MEA (de extrato de malte), ai vão as proporções
Quantidade | Ingrediente |
|---|---|
1 Tbsp | Agar |
1.5tsp | Extrato de Malte Seco (DME) |
250ml | Água |
Resultados: Um agar homogeneo, claro (o mais claro que consegui com uma marca culinária) e um pouco mais mais resistente que o anterior, consistencia bem parecida com um silicone. A homogeneidade e clareza desse agar facilita muito mais a identificação de agentes contaminantes.
Logo quando transferi para os pratos de MEA ja pude observar na pratica os resultados de um agar claro e homogeneo, o prato pintado nos resultados dessa leva aparentemente está contaminado (a condesação na tampa não tem forma típica). O resto dos inoculados tem uma fina circumferencia em volta do micelio, vou esperar alguns dias caso seja consendação. No mais essas proporções me renderam bons resultados a um preço acessível, o problema agora é sanitário (casa antiga e cheia de mofo), ironicamente estou tendo problemas com bactérias e não mofo.



Anexos
Última edição: