- 25/02/2011
- 394
- 85
Olá,
Estou fazendo alguns testes com a utilização do peróxido de hidrogênio nas placas de petri, tomei como base o livro Psilocybin Mushroom Handbook (https://teonanacatl.org/threads/psilocybin-mushroom-handbook.6104).
Como primeiro teste, após distribuir o ágar entre as placas, apenas as envolvi em papel filme e as deixei na incubadora por uma semana.
Nenhuma delas apresentou qualquer sinal do desenvolvimento de contaminantes, o que considerei um excelente sinal.
Continuando com os testes, fiz a transferência de uma pequena porção de micélio para cada uma delas, para observar como seria o desenvolvimento. Aqui estou tendo uma situação bem curiosa e gostaria da opinião de vocês.

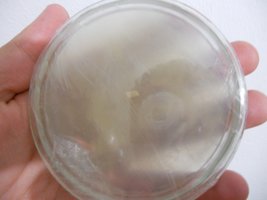
Micélio inicial e porção transferida à nova placa
Em algumas placas o micélio se recusa a colonizar o ágar, em outras até está acontecendo uma colonização, mas praticamente desprezível.
Essa transferência foi feita há duas semanas


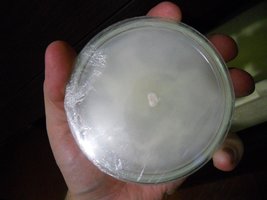
Desenvolvimento em três placas diferentes, após duas semanas
A proporção que utilizei de peróxido foi de 3%. Seria essa proporção alta demais a ponto de agredir um micélio já desenvolvido?
Em caso negativo, o que poderia estar dificultando essa colonização, dado que temperatura e umidade estão controlados e estáveis?
Grato!
Estou fazendo alguns testes com a utilização do peróxido de hidrogênio nas placas de petri, tomei como base o livro Psilocybin Mushroom Handbook (https://teonanacatl.org/threads/psilocybin-mushroom-handbook.6104).
Como primeiro teste, após distribuir o ágar entre as placas, apenas as envolvi em papel filme e as deixei na incubadora por uma semana.
Nenhuma delas apresentou qualquer sinal do desenvolvimento de contaminantes, o que considerei um excelente sinal.
Continuando com os testes, fiz a transferência de uma pequena porção de micélio para cada uma delas, para observar como seria o desenvolvimento. Aqui estou tendo uma situação bem curiosa e gostaria da opinião de vocês.


Micélio inicial e porção transferida à nova placa
Em algumas placas o micélio se recusa a colonizar o ágar, em outras até está acontecendo uma colonização, mas praticamente desprezível.
Essa transferência foi feita há duas semanas



Desenvolvimento em três placas diferentes, após duas semanas
A proporção que utilizei de peróxido foi de 3%. Seria essa proporção alta demais a ponto de agredir um micélio já desenvolvido?
Em caso negativo, o que poderia estar dificultando essa colonização, dado que temperatura e umidade estão controlados e estáveis?
Grato!
