Considerações sobre o isolamento em AGAR
(pontos positivos/vantagens)
1. Rizomórfico: micélio cresce mais rápido (desenvolvimento);
2. Pureza da strain: menos setores algodoados;
3. Micélio mais puro: falta de microorganismos competidores (contaminantes);
4. Resposta mais rápida a formação de primórdias;
5. Maior quantidade de primórdias que se formam;
6. A grande maioria das primórdias chega a fase adulta;
7. Frutos com forma e tamanho adequados;
8. Resistência a contaminantes;
9. Contaminantes podem ser controlados;
10. Tolerância a CO2 e temperatura;
11. Armazenamento de culturas promissoras;
12. Garantias de perpetuação e conservação de uma boa strain;
13. Armazenamento a longo prazo
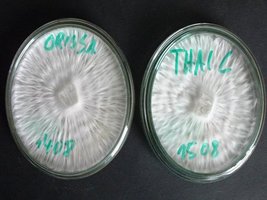
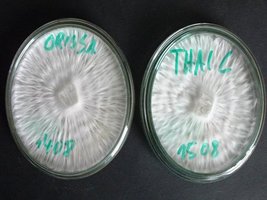
Na fase de crescimento do micélio, nota-se que há diferentes tipos de desenvolvimento deste. Alguns setores podem aparentar uma bela rede (rizomórfico) e outros setores podem aparentar algodoados , fofinhos (tomentose). Tudo isso é normal. O propósito de se trabalhar com agar é isolar o melhor micélio e descartar o micélio fraco e agoldoado (tomentose) que cresce devagar e tem grandes chances de gerar flushes instáveis.
O normal é se efetuar até umas três a quatro transferências em agar até se obter um micélio forte.
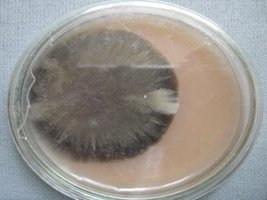
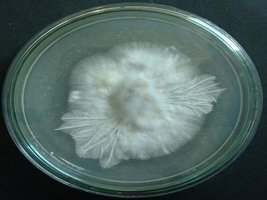
micélio rizomórfico e parte algodoada na mesma placa
Desde que a superfície de agar é dimensional é fácil de se identificar contaminantes e removê-los. Você pode cortar micélio saudável de uma placa contaminada e transferi-lo para uma placa saudável. Geralmente pode acontecer dos contaminantes ainda se desenvolveram na segunda placa, mas já estarão fracos e lentos. Onde o micélio de psilocibe já consegue suprimi-lo e na terceira placa já terá uma cultura limpa.
Agar é somente um meio gelatinoso que firma uma superfície, não é comida. O micélio não irá crescer no agar puro. É preciso acrescentar fontes de carboidratos.
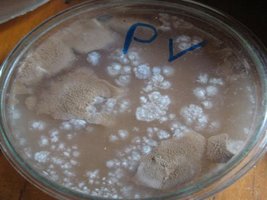
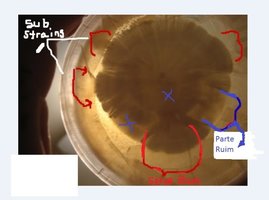
Nessa placa tenho parte de um micélio saudável e um contaminante competindo
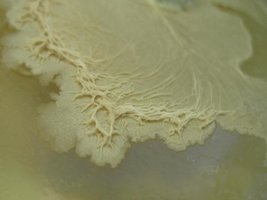
Ficar atento aos setores mais rizomórficos e de crescimento mais acelerado, é esse setor que deve ser retirado para outra placa, é esse o micélio ideal.
Para a incubação dos esporos, de preferência deixá-los em local escuro, virados de cabeça para baixo, para a água da condensação não ter contato com a superfície da cultura. Em torno de 05 a 07 dias já nota-se o micélio.
É aconselhável não deixar o micélio atingir a lateral dos discos/potes, esses são pontos estratégicos dos contaminantes externos.
O agar vai ficar mole (derreter) a 95ºC e permanecer estável até 45ºC. Posso armazenar vidros com a cultura em agar pronta na geladeira, solidificada. Quando vou usá-la posso torná-la líquida no microondas em cerca de 3min. Cuidando para não ferver.
Para fazer o meio de cultura usei dos seguintes materiais:
500ml Água mineral proveniente da fervura prévia de 200g de batata cozida. No processo de fervura (30min) sempre observar e manter o nível de água em 500ml. Pois durante a fervura a água vai evaporar e minha medida final não pode diminuir. Posso ir adicionando água conforme convier. Conforme foto, coe a água das batatas em potes de vidro esterilizados.
Dextrose: 10g
Dextrose é o carboidrato de que o fungo vai se alimentar.
Agar: 10g
O ágar-ágar, também conhecido simplesmente como
ágar, é extraído de diversos gêneros e espécies de algas marinhas vermelhas. O ágar-ágar é insolúvel em água fria, porém, expande-se consideravelmente e absorve uma quantidade de água de cerca de vinte vezes o seu próprio peso, formando um gel não-absorvível, não-fermentável e com importante característica de ser atóxico.
é um composto que forma uma massa gelatinosa
Misturar todos os ingredientes e colocar dentro de vidros onde serão esterilizados na panela de pressão por 1 hora.
Trabalhe dentro de uma glovebox, a sua própria respiração irá facilmente comprometer a cultura. Aqui um plástico protege a cultura do contato com o ambiente externo. Plástico de embrulhar carne, semelhante ao parafilm™.
Inoculação multi-esporos proveniente de um carimbo, método de raspagem. Uma quantidade de esporos bem pequena é raspada dentro da placa.
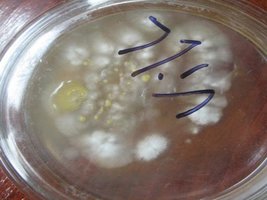
Nessa foto a quantidade de esporos já excedeu em muito o ideal.
Além da raspagem direta de esporos, posso também inocular através de seringa, esporos já previamente "hidratados".
O ideal é se usar placas petri™, próprias para se trabalhar com culturas de fungos. Estas já vem esterilizadas de fábrica. Podendo optar pelas de plástico (utilizadas somente uma vez) ou pelas de vidro (onde é feito o re-aproveitamento através de esterilização em água fervente).
Mas também posso improvisar com outros materiais, como tampas de vidros de conserva, potes de polipropileno, etc.
Culturas prontas podem ser armazenadas na geladeira para posterior uso.
E culturas com micélio já desenvolvido também podem ser armazenadas na geladeira.
Para transferir uma cultura saudável para outra placa...
Os pedaços retirados (cortados) do micélio devem ser bem pequenos, aproximando o tamanho de um grão de arroz, ou até menor melhor, para não se coletar tanto "sub-setores" e sim somente um setor.
Pedaços de tecido de cogumelo em desenvolvimento (clonagem):
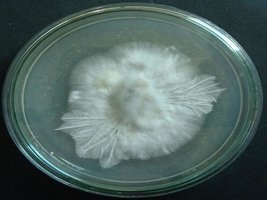
micélio saudável mas não rizomórfico
micélio saudável rizomórfico e agoldoado
rede micelial fraca
Rede micelial forte, rizomórfica, já comendo as beiradas e com um pequeno contaminante ao fundo (direita superior). Com primórdias, pins e cogumelo maduro.
exemplares 100%





















(pontos positivos/vantagens)
1. Rizomórfico: micélio cresce mais rápido (desenvolvimento);
2. Pureza da strain: menos setores algodoados;
3. Micélio mais puro: falta de microorganismos competidores (contaminantes);
4. Resposta mais rápida a formação de primórdias;
5. Maior quantidade de primórdias que se formam;
6. A grande maioria das primórdias chega a fase adulta;
7. Frutos com forma e tamanho adequados;
8. Resistência a contaminantes;
9. Contaminantes podem ser controlados;
10. Tolerância a CO2 e temperatura;
11. Armazenamento de culturas promissoras;
12. Garantias de perpetuação e conservação de uma boa strain;
13. Armazenamento a longo prazo
Na fase de crescimento do micélio, nota-se que há diferentes tipos de desenvolvimento deste. Alguns setores podem aparentar uma bela rede (rizomórfico) e outros setores podem aparentar algodoados , fofinhos (tomentose). Tudo isso é normal. O propósito de se trabalhar com agar é isolar o melhor micélio e descartar o micélio fraco e agoldoado (tomentose) que cresce devagar e tem grandes chances de gerar flushes instáveis.
O normal é se efetuar até umas três a quatro transferências em agar até se obter um micélio forte.
micélio rizomórfico e parte algodoada na mesma placa
Desde que a superfície de agar é dimensional é fácil de se identificar contaminantes e removê-los. Você pode cortar micélio saudável de uma placa contaminada e transferi-lo para uma placa saudável. Geralmente pode acontecer dos contaminantes ainda se desenvolveram na segunda placa, mas já estarão fracos e lentos. Onde o micélio de psilocibe já consegue suprimi-lo e na terceira placa já terá uma cultura limpa.
Agar é somente um meio gelatinoso que firma uma superfície, não é comida. O micélio não irá crescer no agar puro. É preciso acrescentar fontes de carboidratos.
Nessa placa tenho parte de um micélio saudável e um contaminante competindo
Ficar atento aos setores mais rizomórficos e de crescimento mais acelerado, é esse setor que deve ser retirado para outra placa, é esse o micélio ideal.
Para a incubação dos esporos, de preferência deixá-los em local escuro, virados de cabeça para baixo, para a água da condensação não ter contato com a superfície da cultura. Em torno de 05 a 07 dias já nota-se o micélio.
É aconselhável não deixar o micélio atingir a lateral dos discos/potes, esses são pontos estratégicos dos contaminantes externos.
O agar vai ficar mole (derreter) a 95ºC e permanecer estável até 45ºC. Posso armazenar vidros com a cultura em agar pronta na geladeira, solidificada. Quando vou usá-la posso torná-la líquida no microondas em cerca de 3min. Cuidando para não ferver.
Para fazer o meio de cultura usei dos seguintes materiais:
500ml Água mineral proveniente da fervura prévia de 200g de batata cozida. No processo de fervura (30min) sempre observar e manter o nível de água em 500ml. Pois durante a fervura a água vai evaporar e minha medida final não pode diminuir. Posso ir adicionando água conforme convier. Conforme foto, coe a água das batatas em potes de vidro esterilizados.
Dextrose: 10g
Dextrose é o carboidrato de que o fungo vai se alimentar.
Agar: 10g
O ágar-ágar, também conhecido simplesmente como
ágar, é extraído de diversos gêneros e espécies de algas marinhas vermelhas. O ágar-ágar é insolúvel em água fria, porém, expande-se consideravelmente e absorve uma quantidade de água de cerca de vinte vezes o seu próprio peso, formando um gel não-absorvível, não-fermentável e com importante característica de ser atóxico.
é um composto que forma uma massa gelatinosa
Misturar todos os ingredientes e colocar dentro de vidros onde serão esterilizados na panela de pressão por 1 hora.
Trabalhe dentro de uma glovebox, a sua própria respiração irá facilmente comprometer a cultura. Aqui um plástico protege a cultura do contato com o ambiente externo. Plástico de embrulhar carne, semelhante ao parafilm™.
Inoculação multi-esporos proveniente de um carimbo, método de raspagem. Uma quantidade de esporos bem pequena é raspada dentro da placa.
Nessa foto a quantidade de esporos já excedeu em muito o ideal.
Além da raspagem direta de esporos, posso também inocular através de seringa, esporos já previamente "hidratados".
O ideal é se usar placas petri™, próprias para se trabalhar com culturas de fungos. Estas já vem esterilizadas de fábrica. Podendo optar pelas de plástico (utilizadas somente uma vez) ou pelas de vidro (onde é feito o re-aproveitamento através de esterilização em água fervente).
Mas também posso improvisar com outros materiais, como tampas de vidros de conserva, potes de polipropileno, etc.
Culturas prontas podem ser armazenadas na geladeira para posterior uso.
E culturas com micélio já desenvolvido também podem ser armazenadas na geladeira.
Para transferir uma cultura saudável para outra placa...
Os pedaços retirados (cortados) do micélio devem ser bem pequenos, aproximando o tamanho de um grão de arroz, ou até menor melhor, para não se coletar tanto "sub-setores" e sim somente um setor.
Pedaços de tecido de cogumelo em desenvolvimento (clonagem):
micélio saudável mas não rizomórfico
micélio saudável rizomórfico e agoldoado
rede micelial fraca
Rede micelial forte, rizomórfica, já comendo as beiradas e com um pequeno contaminante ao fundo (direita superior). Com primórdias, pins e cogumelo maduro.
exemplares 100%





























Última edição: